
5.仅用一种试剂鉴别如下物质:苯、CCl4、NaI溶液、NaCl溶液、Na2SO3溶液,下列试剂中不能选用的是( )
A.溴水 B.FeCl3溶液
C.酸性KMnO4溶液 D.AgNO3溶液
解析:选D A项,用溴水作用于五种试剂时,苯萃取Br2分层,有机层在上层;CCl4萃取Br2后分层,有机层在下层;Br2与NaI反应溴水橙色褪去,溶液呈棕黄色;与NaCl溶液无明显现象;与Na2SO3作用溴水褪色,正确;B项,FeCl3溶液作用于五种试剂时,苯和CCl4均有分层现象,但苯在上层,CCl4在下层;与NaI作用后,溶液颜色发生变化;与NaCl作用无明显现象;与Na2SO3反应产生红褐色沉淀和气体,正确;C项,用酸性KMnO4溶液时,苯和CCl4均出现分层,但有机层的位置不同,与NaCl溶液无明显现象;与NaI作用时,KMnO4紫色褪去,溶液呈棕黄色;与Na2SO3作用时,KMnO4紫色褪去,正确;D项,无法鉴别NaCl和Na2SO3,因两者均生成白色沉淀。
4.(2014·巢湖模拟)下列有关离子检验的操作和实验结论都正确的是( )
|
选项 |
实验操作及现象 |
实验结论 |
|
A |
向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶解 |
该溶液中一定含有SO |
|
B |
向某溶液中同时加入几滴KSCN溶液和少量新制的氯水,溶液变为红色 |
该溶液中一定含有Fe2+ |
|
C |
向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊 |
该溶液中一定含有CO |
|
D |
向某溶液中加入NaOH溶液并微热,产生能使湿润的红色石蕊试纸变蓝的无色气体 |
该溶液中一定含有NH |
解析:选D A项溶液中也可能有Ag+;B项溶液中不一定含有Fe2+,确定有Fe2+的操作及现象:加KSCN溶液,溶液不变红,再加新制的氯水,溶液变为红色;C项溶液中可能含有HCO、CO、SO、HSO中的一种或几种。
3.实验室一瓶固体M的标签右半部分已被腐蚀,剩余部分只看到“Na2S”字样(如图所示)。已知,固体M只可能是Na2SO3、Na2SiO3、Na2SO4中的一种。若取少量固体M配成稀溶液进行有关实验,下列说法不正确的是( )
A.只用盐酸一种试剂就可以确定该固体M的具体成分
B.往溶液中通入二氧化碳,若有白色沉淀,则固体M为Na2SiO3
C.用pH试纸检验,若pH=7,则固体M一定是Na2SO4
D.往溶液中加入稀硝酸酸化的BaCl2溶液,若有白色沉淀,则固体M为Na2SO4
解析:选D 盐酸遇Na2SO3产生刺激性的SO2气体,与Na2SiO3反应生成H2SiO3沉淀,与Na2SO4不反应,A正确;CO2与Na2SiO3反应生成白色沉淀H2SiO3,B正确;Na2SO3溶液和Na2SiO3溶液pH>7,显碱性,Na2SO4是强酸强碱盐,溶液显中性,C正确;当加入HNO3酸化时,若为Na2SO3,也会被氧化为Na2SO4,再加入BaCl2溶液也会产生白色沉淀BaSO4,D错误。
2.下列说法正确的是 ( )
A.久置的浓HNO3呈黄色,为除去黄色可通入O2
B.NH4Cl固体中混有I2,可用加热的方法除去
C.为除去FeSO4溶液中的Fe2(SO4)3,可加入Cu粉
D.为除去CO2中少量的SO2,可使其通过澄清石灰水
解析:选A 该题主要考查了用化学方法分离、提纯物质的方法。久置的浓HNO3呈黄色是由于硝酸分解生成的NO2溶解导致,通入O2发生反应:4NO2+O2+2H2O===4HNO3,从而可以除去黄色,A正确;NH4Cl固体中混有I2,加热时NH4Cl分解为NH3和HCl,B错误;FeSO4溶液中混有Fe2(SO4)3,加入Cu粉,发生反应:Fe2(SO4)3+Cu===2FeSO4+CuSO4,虽然除去了Fe2(SO4)3,但引入了新杂质CuSO4,C错误;SO2、CO2均能与澄清石灰水反应,除去CO2中少量的SO2,应使其通过饱和NaHCO3溶液:NaHCO3+SO2===NaHSO3+CO2,D错误。

一、选择题
1.下列仪器:①普通漏斗;②容量瓶;③蒸馏烧瓶;④天平;⑤分液漏斗;⑥滴定管;⑦燃烧匙。常用于物质分离的是( )
A.①③④ B.①②⑥ C.①③⑤ D.③④⑦
解析:选C ①普通漏斗:用来过滤分离固液混合物;③蒸馏烧瓶:用于液体蒸馏,分离沸点相差较大的液态混合物;⑤分液漏斗:萃取分离互不相溶的液态混合物。
3.有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中A为非金属元素;A和E属同一族,它们原子最外层电子排布为ns1,B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍。C原子最外层上电子数等于D原子最外层上电子数的一半。
请回答下列问题:
(1)A是__________,B是__________,C是__________,D是________,E是________。
(2)由这五种元素组成的一种化合物是(写化学式)________,写出该物质的一种主要用途:________________________________________________________________________,
(3)写出C元素基态原子的电子排布式:________________________________________________________________________。
(4)用电子排布图表示D元素原子的价电子排布为
________________________________________________________________________。
(5)元素B与D的电负性的大小关系是B________D,C与E的第一电离能的大小关系是C________E(填“>”、“<”或“=”)。
解析:A、B、C、D、E 5种元素核电荷数都小于20,故都为主族元素,A、E同一族且最外层电子排布为ns1,故为第ⅠA族,而A为非金属元素,则A为氢;B、D为同一族,其原子最外层的p能级电子数是s能级电子数的两倍,故其最外层电子排布为ns2np4,为第ⅥA族元素,B核电荷数小于D,则B为氧,D为硫,E为钾;C原子最外层上的电子数为硫原子最外层上电子数的一半,则C为铝,同主族元素自上而下电负性逐渐减小,故B(氧)的电负性大于D(硫),E(钾)的第一电离能小于钠,钠的第一电离能小于C(铝),故第一电离能Al>K。
答案:(1)H O Al S K(写元素名称也可)
(2)KAl(SO4)2·12H2O 净水剂
(3)1s22s22p63s23p1 (4)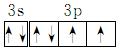
(5)> >
2.根据下列五种元素的第一至第四电离能数据(单位:kJ/mol),回答下列各题:
|
元素代号 |
I1 |
I2 |
I3 |
I4 |
|
Q |
2 080 |
4 000 |
6 100 |
9 400 |
|
R |
500 |
4 600 |
6 900 |
9 500 |
|
S |
740 |
1 500 |
7 700 |
10 500 |
|
T |
580 |
1 800 |
2 700 |
11 600 |
|
U |
420 |
3 100 |
4 400 |
5 900 |
(1)在周期表中,最可能处于同一族的是________。
A.Q和R B.S和T C.T和U
D.R和T E.R和U
(2)下列离子的氧化性最弱的是________。
A.S2+ B.R2+ C.T3+ D.U+
(3)下列元素中,化学性质和物理性质最像Q元素的是________。
A.硼 B.铍 C.氦 D.氢
(4)每种元素都出现相邻两个电离能的数据相差较大的情况,这一事实从一个侧面说明:______________________,如果U元素是短周期元素,你估计它的第2次电离能飞跃数据将发生在失去第________个电子时。
(5)如果R、S、T是同周期的三种主族元素,则它们的原子序数由小到大的顺序是________,其中元素________的第一电离能异常高的原因是________________________________________________________________________。
解析:(1)由表中数据知,R和U的第一至第四电离能变化规律相似,即R和U最可能在同一主族。
(2)离子的氧化性最弱,即其对应的电离能最小。由表中数据看出U的第一电离能为420 kJ/mol,数值最小。
(3)Q元素各电离能都较大,而且各电离能之间无太大差距,故Q最可能为稀有气体元素。
(4)相邻两个电离能数据相差较大,从一个侧面说明电子是分层排布的,且各能层能量不同。若U为短周期元素,据表中数据第一次电离能飞跃是失去第2个电子时,可推知U在第ⅠA族,则第二次电离能飞跃是在失去第10个电子时发生的。
(5)R元素第二电离能有较大飞跃,S元素第三电离能有较大飞跃,T元素第四电离能有较大飞跃,由题意知三者为同周期三种主族元素,可推知R在第ⅠA族,S在第ⅡA族,T在第ⅢA族,故原子序数R<S<T,由表中数据知S元素的电离能异常高,其原因是S元素的最外层电子处于s能级全充满状况,能量较低,比较稳定,失去一个电子吸收的能量较多。
答案:(1)E (2)D (3)C
(4)电子分层排布,各能层能量不同 10
(5)R<S<T S S元素的最外层电子处于s能级全充满状态,能量较低,比较稳定,失去一个电子吸收的能量较多
1.现有部分前四周期元素的性质、原子结构如表所示:
|
元素编号 |
元素性质、原子结构 |
|
A |
第三周期中单质熔点最高 |
|
B |
L层s电子数比p电子数少1 |
|
C |
第三周期主族元素中其电负性最大 |
|
D |
元素的2p轨道无空轨道,且有两个单电子 |
|
E |
E的基态原子最外层电子排布式为3s23p1 |
试回答下列问题:
(1)B常见单质分子的电子式为________,含有σ键和π键个数比为________,该分子的一种等电子体分子为________(任写一种);B的气态氢化物、Cl2、O2三种气体在水中的溶解性差异大的原因是 。
(2)BC3分子中B原子的杂化轨道类型为________。
(3)元素B的10e-氢化物与元素C的18e-的氢化物反应得到的产物的晶体类型为________。
(4)如图所示为某A与氧离子的空间结构示意图(虚线不表示共价键)。通过观察分析,下列叙述正确的有________。
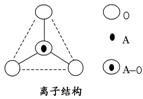
A.键角为120° B.化学组成为SiO
C.键角为109°28′ D.化学组成为SiO
(5)在25 ℃,101 kPa下,已知13.5 g的E固体单质在D2气体中完全燃烧后恢复至原状态,放热419 kJ,该反应的热化学方程式是________________,反应产物为离子化合物,其熔点较高,原因是 。
解析:A是第三周期中熔点最高的单质即为Si;B的L层p电子数为3,B是N;同一周期,电负性最大的主族元素在第ⅦA族,C为Cl;D的2p轨道电子排布图为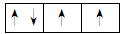 ,则D为O;E的核外电子排布式为[Ne]3s23p1,则E为Al。
,则D为O;E的核外电子排布式为[Ne]3s23p1,则E为Al。
(1)B常见单质是N2,电子式为?N⋮⋮N?,1个σ键,2个π键,等电子体可以是CO,B的气态氢化物为NH3,与水都是极性分子,氨分子能和水反应生成可溶于水的NH3·H2O,NH3与水分子又可以形成氢键,所以氨气在水中溶解度最大;氯气和氧气均为非极性分子,但氯气可与水反应生成可溶的HCl和HClO,所以氯气溶解度次之,氧气最小。
(2)NCl3中心原子N上有1对孤电子对,价层电子对数为3,所以N原子为sp3杂化。
(3)NH3+HCl===NH4Cl,NH4Cl晶体类型为离子晶体。
(4)空间结构是正四面体,键角是109°28′,C正确;化学组成为SiO,D正确。
(5)13.5 g Al的物质的量n(Al)==0.5 mol,则2 mol Al放热419 kJ×4=1 676 kJ,所以热化学方程式为2Al(s)+O2(g)===Al2O3(s) ΔH=-1 676 kJ/mol。
Al2O3属于离子晶体,晶格能较大,所以熔点较高。
答案:(1)?N⋮⋮N? 1∶2 CO
氨分子和水分子均为极性分子,氨分子能和水反应生成可溶于水的NH3·H2O,NH3可与水分子形成氢键,故氨气在水中溶解度最大;氯气和氧气均为非极性分子,但氯气可与水反应生成可溶的HCl和HClO,故氯气溶解度次之,氧气最小
(2)sp3 (3)离子晶体 (4)C、D
(5)2Al(s)+O2(g)===Al2O3(s) ΔH=-1 676 kJ/mol
Al2O3属于离子晶体,其晶格能较大
10.(2014·长沙模拟)下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
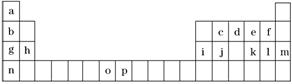
(1)元素p为26号元素,请写出其基态原子电子排布式 。
(2)d与a反应的产物的分子中,中心原子的杂化形式为____________。
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:
________________________________________________________________________。
(4)o、p两元素的部分电离能数据列于表中:
|
元素 |
o |
p |
|
电离能(kJ/mol) |
|
|
|
I1 |
717 |
759 |
|
I2 |
1 509 |
1 561 |
|
I3 |
3 248 |
2 957 |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是 。
(5)第三周期8种元素按单质熔点高低的顺序如图(Ⅰ)所示,其中电负性最大的是________________[填图(Ⅰ)中的序号]。
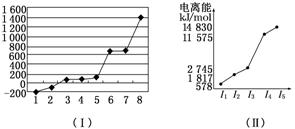
(6)表中所列的某主族元素的电离能情况如图(Ⅱ)所示,则该元素是________________(填元素符号)。
解析:(1)根据能量最低原理、泡利原理和洪特规则可知26号元素基态原子电子排布式为1s22s22p63s23p63d64s2。
(2)d为N元素,a为H元素,二者形成的NH3中N原子的杂化形式为sp3。
(3)h为Mg元素,Mg单质在空气中燃烧发出耀眼的白光,电子从能量较高的轨道跃迁到能量较低的轨道时,以光(子)的形式释放能量。
(4)o元素为Mn,其基态原子电子排布式为:
1s22s22p63s23p63d54s2,Mn2+的基态离子的电子排布式为1s22s22p63s23p63d5,其3d能级为半充满结构,相对比较稳定,当其失去第三个电子时比较困难,而p2+的基态离子的电子排布式为1s22s22p63s23p63d6,其3d能级再失去一个电子即为半充满结构,形成相对比较稳定的结构,故其失去第三个电子比较容易。
(5)第三周期8种元素分别为钠、镁、铝、硅、磷、硫、氯、氩,其单质中钠、镁、铝形成金属晶体,熔点依次升高;硅形成原子晶体;磷、硫、氯、氩形成分子晶体,且常温下磷、硫为固体,氯气、氩为气体,故8种元素按单质熔点由高到低的顺序为硅、铝、镁、硫、磷、钠、氯、氩,其中电负性最大的为氯。 (6)由图可知,该元素的电离能I4 远大于I3,故为第ⅢA族元素,周期表中所列的第ⅢA族元素i属于第三周期,应为Al。
答案:(1)1s22s22p63s23p63d64s2 (2)sp3
(3)电子从能量较高的轨道跃迁到能量较低的轨道时,以光(子)的形式释放能量
(4)Mn2+的3d轨道电子排布为半满状态,比较稳定
(5) 2 (6)Al

9.如表列出前20号元素中的某些元素性质的一些数据:
|
元素 |
原子半径(10-10m) |
最高价态 |
最低价态 |
|
① |
1.02 |
+6 |
-2 |
|
② |
2.27 |
+1 |
- |
|
③ |
0.74 |
- |
-2 |
|
④ |
1.43 |
+3 |
- |
|
⑤ |
0.77 |
+4 |
-4 |
|
⑥ |
1.10 |
+5 |
-3 |
|
⑦ |
0.99 |
+7 |
-1 |
|
⑧ |
1.86 |
+1 |
- |
|
⑨ |
0.75 |
+5 |
-3 |
|
⑩ |
1.17 |
+4 |
-4 |
试回答下列问题:
(1)以上10种元素中,第一电离能最小的是________(填编号)。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每一个原子都满足8电子稳定结构的物质可能是________(写分子式)。元素⑨和⑩形成的化合物的化学式为________,元素①的原子价电子排布式是________。
(3)①⑥⑦⑩四种元素的气态氢化物的稳定性,由强到弱的顺序是________________(填化学式)。
(4)③和⑨两元素比较,非金属性较弱的是________(填名称),可以验证你的结论的是下列中的________(填序号)。
A.气态氢化物的挥发性和稳定性
B.单质分子中的键能
C.两元素的电负性
D.含氧酸的酸性
E.氢化物中X—H键的键长(X代表③和⑨两元素)
F.两单质在自然界的存在形式
解析:由题意可知,10种元素是前20号元素,根据表中数据,我们不难推出①S,②K,③O,④Al,⑤C,⑥P,⑦Cl,⑧Na,⑨N,⑩Si。
(1)在同一周期中,从第ⅠA族到第ⅦA族,元素的第一电离能呈增大趋势;同一主族中,从上向下,元素的第一电离能逐渐减小,故在10种元素中,第一电离能最小的是②K。
(2)C、P、Cl中的某两种元素形成的化合物中,PCl3或CCl4分子中的每一个原子都满足8电子稳定结构;根据化合价知氮和硅形成氮化硅:Si3N4;硫元素的原子价电子排布式是3s23p4。
(3)元素的非金属性越强,形成气态氢化物越稳定,非金属性强弱为Cl>S>P>Si,故其氢化物稳定性为HCl>H2S>PH3>SiH4。
(4)氧元素和氮元素相比,非金属性较弱的是氮元素,可通过C、E验证。
答案:(1)② (2)PCl3、CCl4 Si3N4 3s23p4
(3)HCl>H2S>PH3>SiH4 (4)氮元素 C、E
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com