
1.有下列三种含杂质的气体(括号内为杂质):①CO2(HCl) ②H2(HCl) ③NH3(水蒸气)。某学生欲除去以上气体中的杂质依次选用了三种试剂,该学生选用的试剂均正确的是( )
A.NaHCO3溶液、NaOH溶液、碱石灰
B.Na2CO3溶液、浓硫酸、碱石灰
C.NaHCO3溶液、NaOH溶液、浓硫酸
D.NaOH溶液、浓硫酸、碱石灰
解析:选A B项,Na2CO3溶液与CO2发生反应生成NaHCO3,浓硫酸不能除去HCl气体;C项,浓H2SO4能吸收NH3;D项,NaOH溶液与CO2反应,浓H2SO4不能除去HCl气体。B、C、D错误。
14.A、B、C、D、E五种盐,它们的阳离子可能是Na+、NH、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO、SO、CO。
已知:①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中分别滴加氨水,E和C的溶液中生成沉淀,继续滴加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。
回答下列问题:
(1)五种盐中,一定没有的阳离子是________;所含阴离子相同的两种盐是________(用编号表示)。
(2)D的化学式是________,推断的理由是_________________________________
________________________________________________________________________。
(3)A和C的溶液反应的离子方程式是____________________;
E和氨水反应的离子方程式是_______________________________________。
(4)若要检验B中所含的阳离子,正确的实验方法是_____________________________。
解析:因五种溶液均为无色,所以可迅速排除Cu2+和Fe3+两种离子。根据⑤可知C是AgNO3,E中含有Al3+。又由于在E中加入Ba(NO3)2溶液可产生沉淀,则E中的阴离子是SO(不可能是CO,因为Al3+与CO会发生水解相互促进的反应而不能大量共存),因此E是Al2(SO4)3。由于D的焰色反应呈黄色,所以D中含有Na+,又由于D的溶液呈碱性,因此D是强碱弱酸盐,结合题意可知D只能是Na2CO3。由于B溶液呈酸性,在B溶液中加入Ba(NO3)2溶液产生沉淀,故B是(NH4)2SO4。最后根据⑥可判断A是BaCl2。综上,A、B、C、D、E分别是:BaCl2、(NH4)2SO4、AgNO3、Na2CO3、Al2(SO4)3。
答案:(1)Cu2+、Fe3+ B、E
(2)Na2CO3 由D的焰色反应呈黄色可知阳离子为Na+,由D溶液呈碱性可知阴离子为CO
(3)Ag++Cl-===AgCl↓
Al3++3NH3·H2O===Al(OH)3↓+3NH
(4)取少量B于试管中,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸放在试管口,观察是否变蓝色

13.(2014·江南模拟)某废液中含有大量的K+、Cl-、Br-,还有少量的Ca2+、Mg2+、SO。某研究性学习小组利用这种废液来制取较纯净的氯化钾晶体及液溴(Br2),设计了如图所示的流程图:
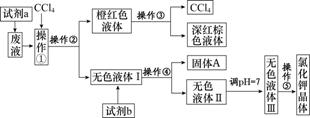
可供试剂a、试剂b(试剂b代表一组试剂)选择的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、KOH溶液、BaCl2溶液、Ba(NO3)2 溶液、H2O2溶液、酸性KMnO4溶液、稀盐酸。
请根据流程图,回答相关问题:
(1)试剂a应该选用______________。
(2)操作①②③④⑤的名称是________(填序号)。
A.萃取、过滤、分液、过滤、蒸发结晶
B.萃取、分液、蒸馏、过滤、蒸发结晶
C.分液、萃取、过滤、过滤、蒸发结晶
D.萃取、分液、分液、过滤、蒸发结晶
(3)除去无色液体Ⅰ中的Ca2+、Mg2+、SO,选出试剂b所代表的试剂,按滴加顺序依次是____________________(填化学式)。
(4)调节pH的作用是________________________,操作方法是_____________________。
(5)操作⑤中用到的瓷质仪器名称是___________________________________。
解析:(1)由加入的CCl4及得到的深红棕色液体知,试剂a能将Br-氧化为Br2,试剂a应具有氧化性,所以应选用H2O2溶液。(3)由流程图知,无色液体Ⅰ中含有K+、Cl-、Ca2+、Mg2+、SO,无色液体Ⅲ中只含有K+、Cl-,则试剂b的作用是除去Ca2+、Mg2+、SO。由于除杂时除杂试剂需过量,且不能引入新杂质,所以欲除去Ca2+,选用饱和K2CO3溶液;欲除去Mg2+,选用KOH溶液;欲除去SO,选用BaCl2溶液。所以欲除去无色溶液Ⅰ中的Ca2+、Mg2+、SO,只要满足BaCl2溶液在饱和K2CO3溶液之前加入即可。(4)由以上知,无色液体Ⅱ中还含有杂质离子CO和OH-,所以需用盐酸来除去剩余的OH-及CO;调节pH=7的操作方法是滴加盐酸,无气体产生时,用pH试纸测定至pH=7。(5)由于操作⑤是蒸发结晶,所以该操作用到的瓷质仪器是蒸发皿。
答案:(1)H2O2溶液 (2)B (3)BaCl2、K2CO3、KOH(或KOH、BaCl2、K2CO3或BaCl2、KOH、K2CO3) (4)除去过剩的OH-及CO 滴加稀盐酸,无气体产生时,用pH试纸测定至溶液的pH=7 (5)蒸发皿
12.某溶液含有的离子为表中离子中的几种(不考虑水的电离及离子的水解)。溶液中阴离子的物质的量为 0.2 mol,阳离子的物质的量为0.3 mol,阳离子只有两种。
|
阳离子 |
Ba2+ NH Fe3+ Al3+ Fe2+ |
|
阴离子 |
OH- CO Cl- SO SO |
①向原溶液中加入过量稀盐酸,无气体生成,得到溶液A。
②向溶液A中加入过量稀HNO3,再加AgNO3溶液,析出白色沉淀。过滤,得到滤液B。
③往滤液B中加入过量NaOH溶液并加热,有4.48 L刺激性气味的气体产生(不考虑气体溶解于水或与水反应,体积已折算为标准状况下的体积),同时有红褐色沉淀生成。过滤,得到滤液C,此过程中沉淀的量不减少。
④向原溶液中加入稀HNO3,再加入足量BaCl2溶液,有46.6 g白色沉淀生成。
根据上述实验回答下列问题。
(1)写出步骤③中产生红褐色沉淀的离子方程式:
________________________________________________________________________。
(2)原溶液中一定不存在的阴离子是_________________________________。
(3)原溶液中的物质在空气中很容易被氧化,设计简单实验予以证明。简述操作步骤及可能观察到的实验现象:
________________________________________________________________________。
(4)若原溶液由一种盐溶解于水制得,则该盐的化学式为
__________________。
(5)若原溶液由R和M(摩尔质量R>M)两种盐溶解于水制得,则R和M的化学式分别为________、________,其物质的量之比为________。实验室用工业废料制备盐R,在利用重结晶方法精制该盐时,需要趁热过滤,趁热过滤的目的是______________________________。
解析:由①可知溶液中不含SO和CO,由④可知溶液中含有SO,n(SO)=n(BaSO4)=0.2 mol,由于溶液中阴离子的物质的量为0.2 mol,所以溶液中含有的阴离子只有SO。由于含有SO,故不含Ba2+。由③可知溶液中含有NH,n(NH)=n(NH3)=0.2 mol,由溶液中阳离子的物质的量为0.3 mol和电荷守恒可知,溶液中的另一种阳离子只能是Fe2+。综上,溶液中含有NH、Fe2+和SO。
答案:(1)Fe3++3OH-===Fe(OH)3↓
(2)OH-、CO、Cl-、SO
(3)取原溶液少许于试管中,滴加KSCN溶液,若溶液变为红色,则证明原溶液中有物质被氧化(其他合理答案均可)
(4)(NH4)2Fe(SO4)2
(5)FeSO4 (NH4)2SO4 1∶1 减少过滤时FeSO4的损失
11.紫菜与海带类似,是一种富含生物碘的海洋植物。商品紫菜轻薄松脆、比海带更易被焙烧成灰(此时碘转化为碘化物无机盐),用于碘单质的提取。
|
|
乙醇 |
四氯化碳 |
碘(晶体) |
|
密度(g/cm3) |
0.789 3 |
1.595 |
4.94 |
|
沸点(℃) |
78.5 |
76.8 |
184.35 |
(1)实验室中焙烧紫菜用到的仪器有________(填写相应的字母)。
A.烧杯 B.表面皿 C.蒸发皿 D.坩埚 E.试管
F.酒精灯 G.三脚架 H.泥三角
(2)将焙烧所得的紫菜灰与足量的双氧水和稀硫酸作用,其目的是________________________________________________________________________。
(3)________(填一种基本操作的名称),弃去残渣,将所得的产物转入________(填一种玻璃仪器的名称)中,加入少量的________(填本题表格中一种最佳化学试剂的名称),振荡、静置,首先将________分离出来。
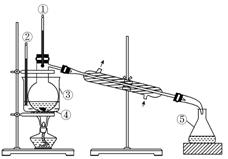
(4)将装置图中缺少的必要仪器补画出来以最终获得固态的单质碘(不考虑碘的进一步提纯)。
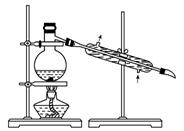
解析:本题的实验目的是从紫菜中提取碘单质。操作过程是将紫菜焙烧,将碘转化为碘单质,利用分液的方法分离出碘的有机溶液,然后再蒸馏。(1)焙烧需要坩埚,坩埚放在泥三角上,泥三角放在三脚架上加热。(3)选用四氯化碳作萃取剂,有机层在下层,首先分离出下层液体。
答案:(1)D、F、G、H (2)将溶液中的I-转化为I2
(3)过滤 分液漏斗 四氯化碳 紫色下层液体
(4)①、②中只要画出一个即可,③、④、⑤必画(其中③水溶液液面与烧杯内液体相对高度可不作要求,⑤必须是锥形瓶、木块可以不画)
二、非选择题
10.实验室有NaHSO4、Ba(OH)2、NH3·H2O、NaHCO3、KAl(SO4)2五种无色溶液,现欲通过它们之间的相互反应的现象对其进行鉴别。部分物质间的反应现象如表所示。
|
|
A |
B |
C |
D |
E |
|
A |
|
|
|
↓ |
|
|
B |
|
|
↑ |
|
↓ |
|
C |
|
↑ |
|
↓↑ |
↓ |
|
D |
↓ |
|
↑↓ |
|
↓ |
|
E |
|
↓ |
↓ |
↓ |
|
表中“↑”表示生成气体物质,“↓”表示生成沉淀。
根据以上信息,回答以下问题。
(1)B、E的化学式分别为________、________。
(2)写出A的电离方程式:___________________________________________。
(3)C、D两溶液反应的离子方程式为_________________________________。
(4)向含有0.1 mol溶质的D溶液中滴加E溶液,所生成沉淀的物质的量之和最多为________mol。
解析:(1)C与D反应生成气体和沉淀,则C、D分别是NaHCO3、KAl(SO4)2之一。B与C反应只有气体生成,则B、C分别是NaHSO4和NaHCO3之一。据此可知C是NaHCO3,则D是KAl(SO4)2,B是NaHSO4。又由于E与B、C、D反应都有沉淀生成,故E是Ba(OH)2,A是NH3·H2O。(2)NH3·H2O是弱电解质,书写其电离方程式时要用可逆符号。(3)Al3+与HCO发生的是水解相互促进的反应。(4)当KAl(SO4)2与Ba(OH)2按1∶1.5 的物质的量之比混合时,Al3+恰好完全沉淀,方程式为2KAl(SO4)2+3Ba(OH)2===2Al(OH)3↓+3BaSO4↓+K2SO4;当KAl(SO4)2与Ba(OH)2按1∶2的物质的量之比混合时,SO完全沉淀,方程式为KAl(SO4)2+2Ba(OH)2===KAlO2+2BaSO4↓+2H2O。可见,当KAl(SO4)2与Ba(OH)2按1∶1.5的物质的量之比混合时,沉淀量最多。观察方程式可知0.1 mol KAl(SO4)2参与反应时生成0.25 mol 沉淀。
答案:(1)NaHSO4 Ba(OH)2
(2)NH3·H2ONH+OH-
(3)Al3++3HCO===Al(OH)3↓+3CO2↑
(4)0.25
9.有一澄清透明溶液,只可能含有大量H+、Fe3+、Fe2+、Al3+、AlO、CO、NO七种离子中的几种,向溶液中逐滴加入一定量1 mol/L的NaOH溶液的过程中,开始没有沉淀,而后有沉淀,沉淀达最大量后继续滴加NaOH溶液沉淀部分消失,下列判断正确的是 ( )
A.一定不含Fe3+和Fe2+
B.一定含有Al3+,Fe3+、Fe2+至少含有一种或两种皆有
C.溶液可能含有NO
D.一定含有Fe3+,但一定不含Fe2+
解析:选D 向溶液中滴加NaOH溶液的过程中,开始没有沉淀,则说明溶液中含H+,则无AlO和CO,根据溶液为电中性,则必有NO,NO在酸性溶液中能氧化Fe2+,则溶液中一定没有Fe2+,再滴加NaOH溶液,出现沉淀,而后沉淀部分溶解,则说明溶液中一定含Al3+和Fe3+,综上所述,D正确。
8.某溶液中可能含有K+、NH、Ba2+、SO、I-、CO。分别取样:①用pH计测试,溶液显弱酸性;②加氯水和CCl4振荡后静置,下层呈无色。为确定该溶液的组成,还需检验的离子是( )
A.K+ B.SO C.Ba2+ D.NH
解析:选A 根据①溶液呈弱酸性,可知溶液中不含CO而含有NH;根据②可知溶液中不含I-;溶液中至少要含有一种阴离子,即SO。SO与Ba2+不能共存,则溶液中不含Ba2+。只有K+不能确定,还需要进一步检验。
7.下列各组物质的无色溶液,不用其他试剂即可鉴别的是( )
A.NaOH、AlCl3 B.NaHCO3、H2SO4
C.Na2CO3、BaCl2 D.Na2CO3、NaHCO3、Ca(OH)2
解析:选A NaOH和AlCl3互滴有不同的现象。
6.下列实验操作与预期实验目的或所得实验结论一致的是( )
|
选项 |
实验操作 |
实验目的或结论 |
|
A |
向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤 |
除去MgCl2溶液中少量FeCl3 |
|
B |
向某溶液中加入BaCl2溶液生成白色沉淀,继续加稀硝酸沉淀不消失 |
证明溶液中含 SO |
|
C |
向某溶液中加入稀盐酸,放出无色无味气体,将气体通入澄清石灰水,石灰水变浑浊 |
证明该溶液中存在CO |
|
D |
两支试管中装有等体积、等浓度的H2O2溶液,向其中一支试管中加入FeCl3溶液 |
FeCl3溶液对 H2O2分解速 率无影响 |
解析:选A FeCl3溶液中存在水解平衡:Fe3++3H2OFe(OH)3+3H+,加入足量Mg(OH)2粉末(不引入新的杂质离子)能使水解平衡正向移动,Fe3+以Fe(OH)3的形式而沉淀析出,从而达到除杂的目的,A正确;“向某溶液中加入BaCl2溶液生成白色沉淀,继续加稀硝酸沉淀不消失”,该溶液中可能存在Ag+、SO、HSO,B错误;“向某溶液中加入稀盐酸,放出无色无味气体,将气体通入澄清石灰水,石灰水变浑浊”,该溶液中还可能存在HCO等,C错误;FeCl3溶液对H2O2分解有催化作用,D错误。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com