
2.常温下,下列叙述不正确的是( )
A.c(H+)>c(OH-)的溶液一定显酸性
B.pH=3的弱酸溶液与pH=11的强碱溶液等体积混合后溶液呈酸性
C.pH=5的硫酸溶液稀释到原来的500倍,稀释后 c(SO)与c(H+)之比约为1∶10
D.中和10 mL 0.1 mol/L醋酸与100 mL 0.01 mol/L醋酸所需NaOH的物质的量不同
解析:选D B项,pH=3的弱酸溶液与pH=11的强碱溶液等体积混合,弱酸浓度大,有大量剩余,反应后溶液显酸性;C项,pH=5的硫酸溶液稀释到原来的500倍,则溶液接近于中性,c(H+)约为10-7 mol/L,c(SO)=10-5/(2×500)=10-8 mol/L,则c(SO)∶c(H+)=1∶10;D项,两份醋酸的物质的量相同,则所需NaOH的物质的量相同,错误。
1.已知NaHSO4在水中的电离方程式为:NaHSO4===Na++H++SO。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。对于该溶液,下列叙述中不正确的是( )
A.该温度下加入等体积pH=12的NaOH溶液可使反应后的溶液恰好呈中性
B.水电离出来的c(H+)=1×10-10 mol/L
C.c(H+)=c(OH-)+c(SO)
D.该温度高于25 ℃
解析:选A 某温度下,pH=6的蒸馏水,Kw=1×10-12,NaHSO4溶液的pH为2,c(H+)=1×10-2 mol/L,pH=12的NaOH溶液,c(OH-)=1 mol/L,反应后的溶液呈碱性。由NaHSO4===Na++H++SO和H2OH++OH-可知C正确。
13.Ⅰ.实验室有一瓶失去标签的某白色固体,已知其成分可能是碳酸或亚硫酸的钠盐或钾盐,且其成分单一。现某化学小组通过如下步骤来确定其成分:
(1)阳离子的确定:
实验方法及现象:_____________________________________________________。
结论:此白色固体是钠盐。
(2)阴离子的确定:
①取少量白色固体于试管中,然后向试管中加入稀盐酸,白色固体全部溶解,产生无色气体,此气体能使溴水褪色。
②要进一步确定其成分需补做如下实验:取适量白色固体配成溶液,取少许溶液于试管中,加入BaCl2溶液,出现白色沉淀。
Ⅱ.确认其成分后,由于某些原因,此白色固体部分被空气氧化,该化学小组想用已知浓度的酸性KMnO4溶液来确定变质固体中X的含量,具体步骤如下:
步骤Ⅰ 称取样品1.000 g。
步骤Ⅱ 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,用0.01 mol/L KMnO4标准溶液滴定至终点。
按上述操作方法再重复2次。
(1)写出步骤Ⅲ所发生反应的离子方程式________________________________。
(2)不用________(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液,原因为:________________________________________________________________________
________________________________________________________________________。
(3)该实验选何种指示剂,说明理由__________________________________________
________________________________________________________________________。
(4)在配制0.01 mol/L KMnO4溶液时若仰视定容,则最终测得变质固体中X的含量________(填“偏大”、“偏小”或“无影响”)。
(5)滴定结果如表所示:
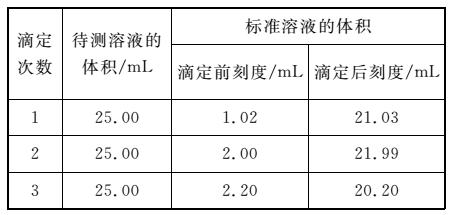
则该变质固体中X的质量分数为________。
解析:Ⅰ.题中一个关键点是白色固体成分单一,由阳离子检验可知该盐是钠盐,由Ⅰ(2)①可知该盐是亚硫酸盐或亚硫酸氢盐,由Ⅰ(2)②可排除该盐是亚硫酸氢盐,该盐应是Na2SO3,Na2SO3在空气中易被氧化生成Na2SO4。
Ⅱ.(2)酸性KMnO4溶液具有强氧化性,要放在酸式滴定管中。
(3)酸性KMnO4被还原为Mn2+后溶液由紫色变为无色,不需要使用指示剂。
(4)配制0.01 mol/L KMnO4溶液时若仰视定容,使c(KMnO4)减小,则在进行滴定操作时消耗V(KMnO4)会变大,导致Na2SO3含量偏大。
(5)分析滴定数据,第三组数据明显偏小,滴定中误差很大,计算时应舍去。
答案:Ⅰ.(1)取固体少许,进行焰色反应实验,焰色为黄色
Ⅱ.(1)2MnO+5SO+6H+===2Mn2++5SO+3H2O
(2)碱 酸性KMnO4溶液能腐蚀橡胶管
(3)不用指示剂,因为MnO全部转化为Mn2+时溶液紫色褪去,现象明显 (4)偏大 (5)63%

12.(2014·黄冈模拟)现有常温条件下甲、乙、丙三种溶液,甲为0.1 mol/L的NaOH溶液,乙为0.1 mol/L的HCl溶液,丙为 0.1 mol/L 的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=__________。
(2)丙溶液中存在的电离平衡为_____________________________________(用电离方程式表示)。
(3)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为________________________。
(4)某同学用甲溶液分别滴定20.00 mL乙溶液和20.00 mL丙溶液,得到如图所示两条滴定曲线,请完成有关问题:
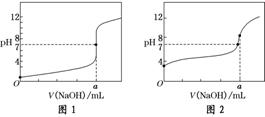
①甲溶液滴定丙溶液的曲线是________(填“图1”或“图2”);
②a=__________ mL。
解析:(1)c(OH-)=0.1 mol/L,则c(H+)=10-13 mol/L,pH=13。
(2)CH3COOH溶液中存在CH3COOH和水的电离平衡。
(3)酸、碱对水的电离具有抑制作用,c(H+)或c(OH-)越大,水的电离程度越小,反之越大。
(4)①氢氧化钠溶液滴定盐酸恰好中和时,pH=7;氢氧化钠溶液滴定醋酸恰好中和时,生成醋酸钠溶液,pH>7。对照题中图示,图2符合题意。②a的数值是通过滴定管读数所确定的,因此读数应在小数点后保留两位。
答案:(1)13
(2)CH3COOH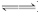 CH3COO-+H+,
CH3COO-+H+,
H2O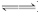 OH-+H+
OH-+H+
(3)丙>甲=乙 (4)①图2 ②20.00
二、非选择题
11.现有常温下的六份溶液:
①0.01 mol/L CH3COOH溶液;
②0.01 mol/L HCl溶液;
③pH=12的氨水;
④pH=12的NaOH溶液;
⑤0.01 mol/L CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;
⑥0.01 mol/L HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是________(填序号,下同),水的电离程度相同的是________。
(2)若将②、③混合后所得溶液pH=7,则消耗溶液的体积:②________③(填“>”、“<”或“=”)。
(3)将六份溶液同等稀释10倍后,溶液的pH:
①________②,③________④,⑤________⑥(填“>”、“<”或“=”)。
(4)将①、④混合,若有c(CH3COO-)>c(H+),则混合溶液可能呈________(填序号)。
A.酸性 B.碱性 C.中性
解析:(1)酸和碱都会抑制水的电离,故只有⑥为NaCl溶液,对H2O的电离无抑制作用。②③和④对水的电离抑制程度相同。
(2)因pH=12的氨水中c(NH3·H2O)>0.01 mol/L,故②、③混合,欲使pH=7,则需②的体积>③的体积。
(3)稀释同样的倍数后,溶液的pH:①>②;③>④;⑤>⑥。
(4)由电荷守恒知:
c(Na+)+c(H+)=c(CH3COO-)+c(OH-),仅知道c(CH3COO-)>c(H+),无法比较c(H+)与c(OH-)的相对大小,也就无法判断混合液的酸碱性,故选A、B、C。
答案:(1)⑥ ②③④ (2)> (3)> > >
(4)A、B、C
10.(2014·哈师大附中模拟)某温度下,水的离子积常数Kw=10-12。该温度下,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合并保持恒温,欲使混合溶液的pH=7,则稀硫酸与NaOH溶液的体积比为( )
A.1∶10 B.9∶1 C.10∶1 D.99∶21
解析:选B 该温度下,pH=7时溶液呈碱性,NaOH过量,pOH=5,=10-5,V(H2SO4)∶V(NaOH)=9∶1。
9.常温下,向0.1 mol/L的H2SO4溶液中逐滴加入0.1 mol/L的Ba(OH)2溶液,生成沉淀的质量与加入Ba(OH)2溶液的体积关系如图所示,下列说法中正确的是( )

A.a~d溶液的pH:a<b<c<d
B.a~d溶液的导电能力:a<b<c<d
C.b处溶液的c(H+)与d处溶液的c(OH-)相等
D.c处溶液和d处溶液均呈碱性
解析:选A A项,0.1 mol/L的H2SO4溶液呈酸性,不断地加入Ba(OH)2溶液,碱性会不断增强,正确;B项,c点是H2SO4和Ba(OH)2恰好中和的点,溶液的离子浓度接近为0,导电能力最差,错误;C项,由图像可知,原硫酸体积为20 mL,b处溶液的c(H+)=[0.1 mol/L×2×0.02 L-0.1 mol/L×2×0.01 L]/0.03 L, d处溶液的c(OH-)=[0.1 mol/L×2×0.03 L-0.1 mol/L×2×0.02 L]/0.05 L,b处溶液的c(H+)不等于d处溶液的c(OH-),错误;D项,c处溶液呈中性,错误。
8.(2014·珠海模拟)
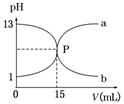
下图曲线a和b是盐酸与氢氧化钠的相互滴定的滴定曲线,下列叙述正确的是( )
A.盐酸的物质的量浓度为1 mol/L
B.P点时反应恰好完全,溶液呈中性
C.曲线a是盐酸滴定氢氧化钠的滴定曲线
D.酚酞不能用作本实验的指示剂
解析:选B 根据曲线a知,滴定前盐酸的pH=1,c(HCl)=0.1 mol/L,A错误;P点表示盐酸与氢氧化钠恰好完全中和,溶液呈中性,B正确;曲线a是氢氧化钠溶液滴定盐酸的曲线,曲线b是盐酸滴定氢氧化钠溶液的曲线,C错误;强酸与强碱滴定,可以用酚酞作指示剂,D错误。
7.如图为对10 mL一定物质的量浓度的盐酸X用一定物质的量浓度的NaOH溶液Y滴定的图像,依据图像推出X和Y的物质的量浓度是表内各组中的( )
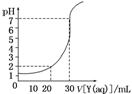
|
|
A |
B |
C |
D |
|
X(mol/L) |
0.12 |
0.04 |
0.03 |
0.09 |
|
Y(mol/L) |
0.04 |
0.12 |
0.09 |
0.03 |
解析:选D 由图知,加入30 mL NaOH溶液后溶液pH=7。即c(HCl)·V(盐酸)=c(NaOH)·V(NaOH溶液),c(HCl)×10×10-3 L=c(NaOH)×30×10-3 L,
c(HCl)=3c(NaOH);又知加入20 mL NaOH溶液时,溶液pH=2则=10-2 mol/L;将c(HCl)=3c(NaOH)代入得c(NaOH)=0.03 mol/L,c(HCl)=0.09 mol/L。
6.25 ℃时,Kw=1.0×10-14;100 ℃时,Kw=1×10-12,下列说法正确的是( )
A.100 ℃时,pH=10的NaOH溶液和pH=2的H2SO4恰好中和,所得溶液的pH=7
B.25 ℃时,0.2 mol/L Ba(OH)2溶液和0.2 mol/L HCl等体积混合,所得溶液的pH=7
C.25 ℃时,0.2 mol/L NaOH溶液与0.2 mol/L CH3COOH恰好中和,所得溶液的pH=7
D.25 ℃时,pH=12的氨水和pH=2的H2SO4等体积混合,所得溶液的pH>7
解析:选D 100 ℃时,NaOH和H2SO4恰好中和时,pH=6,A错误;25 ℃时,c(OH-)=0.4 mol/L,c(H+)=0.2 mol/L,等体积混合后pH大于7,B错误;C项,由于CH3COO-的水解,pH大于7,C错误;D项,氨水过量pH>7,正确。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com