
6.(2014·银川模拟)下列反应不属于取代反应的是( )
A.苯发生硝化反应
B.乙酸发生酯化反应
C.乙烯水化法制乙醇
D.甲烷与氯气生成四氯化碳
解析:选C 乙烯水化法制乙醇属于加成反应。
5.下列化合物中既能使溴的四氯化碳溶液褪色,又能在光照下与溴发生取代反应的是( )
A.甲苯 B.乙醇
C.丙烯 D.乙烯
解析:选C 碳碳双键能使溴的四氯化碳溶液褪色,苯环和乙醇中不含碳碳双键,排除A和B选项;在光照下与溴发生取代反应是烷烃的性质,乙烯中不含烷烃基,排除D选项。
4.(2014·西安模拟)以下有关物质结构的描述正确的是( )
A.甲苯分子中的所有原子可能共平面
B.CH2===CH—C6H5分子中的所有原子可能共平面
C.乙烷分子中的所有原子可能共平面
D.二氯甲烷分子为正四面体结构
解析:选B 由于甲苯、乙烷分子中含—CH3,碳原子四个键为空间四面体结构,不可能全部共面;苯和乙烯均为平面结构,故苯乙烯分子中的所有原子可能共平面;二氯甲烷分子中C—H与C—Cl不相同,故不可能为正四面体结构。
3.下列说法中不正确的是( )
A.煤燃烧时会产生大量的SO2、氮氧化物、碳氧化物和烟尘等污染物
B.石油是由多种烷烃、环烷烃和芳香烃组成的混合物
C.重油裂解是工业上获得乙烯和丙烯的重要方法
D.煤中含有苯和甲苯,可用先干馏后分馏的方法把它们分离出来
解析:选D 煤经干馏得到煤焦油等物质,而煤焦油是由多种芳香族化合物组成的复杂混合物,可分馏得到苯、甲苯等物质,但煤本身不含有苯、甲苯。
2.下列关于有机物的说法正确的是( )
A.煤中含有苯
B.甲烷、氯仿、乙烯和苯都属于烃
C.苯乙烯分子中所有原子可能在同一个平面上
D.乙烯和氢气反应不需要使用催化剂
解析:选C 煤通过干馏所得的煤焦油中含有苯,但煤中不含苯,A错误;氯仿中含有氯原子,不属于烃,B错误;乙烯与氢气反应需要用Ni作催化剂,D错误。
一、选择题
1.下列有机物的结构表示不正确的是( )
A.CH4的球棍模型示意图为 
B.丁烯的结构简式为CH3CH2CH===CH2
C.乙醇的结构式为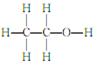
D.葡萄糖的最简式为CH2O
解析:选A  为甲烷的比例模型示意图,A错误。
为甲烷的比例模型示意图,A错误。
6.过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。
请填写下列空白:
(1)移取10.00 mL密度为ρ g/mL的过氧化氢溶液至250 mL________(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。
MnO+ H2O2+ H+=== Mn2++ H2O+
(3)滴定时,将高锰酸钾标准溶液注入________(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是____________________________________________________。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为________。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果__________(填“偏高”、“偏低”或“不变”)。
解析:(1)仪器的选用根据题意应该选用容量瓶。
(2)残缺方程式配平首先应确定缺什么,分析可知缺的是O2,根据电子转移守恒,配平化学方程式。
(3)由于高锰酸钾标准溶液具有强氧化性,所以只能使用酸式滴定管。滴定到达终点的现象是:滴入一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色。
(4)根据配平的化学方程式计算出过氧化氢的量,最后计算出原过氧化氢溶液中过氧化氢的质量分数为。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,有一部分溶液占据了气泡的体积,并没有滴入锥形瓶,则测定结果偏高。
答案:(1)容量瓶 (2)2 5 6 2 8 5 O2
(3)酸式 滴入一滴高锰酸钾溶液,溶液呈浅红色,且30秒内不褪色 (4) (5)偏高
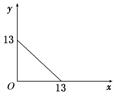
5.某温度(t ℃)下的溶液中,c(H+)=10-x mol/L,c(OH-)=10-y mol/L,x与y的关系如图所示。请回答下列问题:
(1)此温度时,水的离子积Kw为________,则该温度t ℃________25 ℃(填“>”、“<”或“=”)。
(2)若将此温度(t ℃)下,pH=11的苛性钠溶液a L与pH=1 的稀硫酸b L混合(假设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比,并比较溶液中各离子的浓度大小。
①若所得混合液为中性,则a∶b=________;此溶液中各种离子的浓度由大到小排列顺序的是________________________________________________________________________;
②若所得混合液的pH=2,则a∶b=________;此溶液中各种离子的浓度由大到小排列顺序的是________________________________________________________________________。
解析:(1)Kw=c(H+)·c(OH-)=1×10-13=10-13,随着温度的升高,Kw变大,10-13>10-14,所以温度t ℃>25 ℃。
(2)①若混合液为中性,则溶液中c(H+)=c(OH-),10-1 mol/L×b L=10-2 mol/L×a L,则a∶b=10;反应后为NaSO4溶液,存在Na+,SO、H+、OH-,离子浓度由大到小顺序c(Na+)>c(SO)>c(H+)=c(OH-)。
②pH=2,混合液中c(H+)===10-2mol/L
解得a∶b=9∶2;此时溶液为Na2SO4与H2SO4的混合溶液,溶液中存在Na+、SO、H+、OH-,c(Na+)==×10-2 mol/L,c(SO)==×10-2 mol/L,c(H+)=10-2 mol/L,c(OH-)=10-11 mol/L,所以离子浓度由大到小顺序c(H+)>c(SO)>c(Na+)>c(OH-)。
答案:(1)10-13
(2)①10∶1 c(Na+)>c(SO)>c(H+)=c(OH-)
②9∶2 c(H+)>c(SO)>c(Na+)>c(OH-)
4.25 ℃时,用浓度为0.100 0 mol/L的NaOH溶液滴定20.00 mL浓度均为0.100 0 mol/L的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是( )
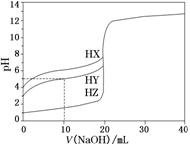
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX
B.根据滴定曲线,可得Ka(HY)≈10-5
C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+)
D.HY与HZ混合,达到平衡时:
c(H+)=+c(Z-)+c(OH-)
解析:选B NaOH体积为0时pH:HX>HY>HZ,所以酸性HZ>HY>HX,因此相同温度下同浓度的三种酸导电能力:HZ>HY>HX,A错误;根据c(H+)≈,10-3≈,Ka(HY)≈10-5,B正确;根据图像,0.100 0 mol/L的HZ溶液pH=1,因此HZ为强酸,则HX和HY为弱酸。将等浓度的HX、HY混合,用NaOH溶液进行滴定,当HX完全反应,则HY已经完全反应,溶液为NaX和NaY的混合液,酸性HY>HX,则溶液中X-水解程度大于Y-水解程度,因此c(Y-)>c(X-)>c(OH-)>c(H+),C错误。
3.在25 ℃时,向V mL pH=m的HNO3中滴加pH=n的KOH溶液10V mL时,溶液中NO的物质的量恰好等于加入的K+的物质的量,则m+n的值为( )
A.13 B.14
C.15 D.不能确定
解析:选A 溶液中NO的物质的量恰好等于加入K+的物质的量,说明反应HNO3+KOH===KNO3+H2O恰好完全进行,溶液呈中性,故n(HNO3)=n(KOH),即V×10-3×10-m=10V×10-3×10n-14,解得:m+n=13。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com