
1.室温时,CaCO3在水中的沉淀溶解平衡曲线如图所示。
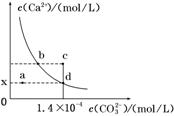
已知CaCO3的溶度积(室温)为2.8×10-9,下列说法中不正确的是( )
A.x的数值为2×10-5
B.c点时有CaCO3生成
C.加入蒸馏水可使溶液由d点变成a点
D.b点与d点对应的溶度积相等
解析:选C Ksp=c(Ca2+)·cd(CO)=1.4×10-4×x,解得x=2×10-5mol/L,A正确;C点Q=c(Ca2+)·cc(CO),
因为cc(CO)>cd(CO),所以Q>Ksp,有CaCO3生成,B正确;加蒸馏水c(Ca2+)与c(CO)同时变化,不能变成a点,C错误;b点与d点温度相同,所以Ksp相同,D正确。
- kJ/mol
(3)3.5×10-11 mol/L 1.2×107 mol/L
(4)Al(OH)3 NaOH
14.25 ℃时几种难溶电解质的溶解度如表所示:
|
难溶电解质 |
溶解度/g |
沉淀完全时的pH |
|
Mg(OH)2 |
9×10-4 |
11.1 |
|
Cu(OH)2 |
1.7×10-6 |
6.7 |
|
Fe(OH)2 |
1.5×10-4 |
9. 6 |
|
Fe(OH)3 |
3.0×10-9 |
3.7 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子。例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可。请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe2+、Fe3+都被转化为________(填化学式)而除去。
(2)①中加入的试剂应该选择__________________,其原因是______________________。
(3)②中除去Fe3+所发生的离子方程式为_______________________________________。
(4)下列与方案③相关的叙述中,正确的是________(填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
解析:实验①中为了不引入杂质离子,应加入氨水使Fe3+沉淀,而不能用NaOH溶液。实验②中根据溶解度数据可知Mg(OH)2能转化为Fe(OH)3,因此在MgCl2溶液中加入足量Mg(OH)2除去Fe3+,然后将沉淀一并过滤。实验③中利用Fe3+极易水解的特点,根据题意可知调节溶液的pH=4可使Fe3+沉淀完全,为了不引入杂质离子,因此可使用CuO、Cu(OH)2等调节溶液的pH。(4)选项B显然是错误的,原因是若不把Fe2+氧化为Fe3+,当Fe2+沉淀完全时,Cu2+也沉淀完全。
答案:(1)Fe(OH)3 (2)氨水 不会引入新的杂质
(3)2Fe3+(aq)+3Mg(OH)2(s)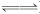 3Mg2+(aq)+2Fe(OH)3(s) (4)ACDE
3Mg2+(aq)+2Fe(OH)3(s) (4)ACDE

13.(2014·鹤岗模拟)氧化铁是一种重要的无机材料,化学性质稳定,催化活性高,具有良好的耐光性、耐热性和对紫外线的屏蔽性,从某种工业酸性废液(主要含Na+、Fe2+、Fe3+、Mg2+、Al3+、Cl-、SO)中回收氧化铁流程如图所示:
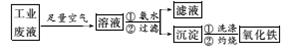
已知:常温下Ksp[Mg(OH)2]=1.2×10-11;Ksp[Fe(OH)2]=2.2×10-16;Ksp[Fe(OH)3]=3.5×10-38;Ksp[Al(OH)3]=1.0×10-33
(1)写出在该酸性废液中通入空气时发生的离子反应方程式:______________________,
指出使用空气的优点是:__________________________________________。
(2)已知Fe3+(aq)+3OH-(aq)===Fe(OH)3(s) ΔH=-Q1 kJ/mol,题(1)中每生成1 mol含铁微粒时,放热Q2,请你计算1 mol Fe2+全部转化为Fe(OH)3(s)的热效应ΔH=________。
(3)常温下,根据已知条件计算在pH=5的溶液中,理论上下列微粒在该溶液中可存在的最大浓度c(Fe3+)=__________,c(Mg2+)=________。
(4)有人用氨水调节溶液pH,在pH=5时将Fe(OH)3沉淀出来,此时可能混有的杂质是________(填化学式,下同),用________试剂可将其除去。
解析:(1)酸性废液中通入空气时,Fe2+被空气中的氧气所氧化,离子方程式为4Fe2++O2+4H+===4Fe3++2H2O。该方法的优点是耗费少且无污染。
(2)根据盖斯定律:1 mol Fe2+全部转化为Fe(OH)3(s)的热效应ΔH=-(Q2+Q1) kJ/mol。
(3)溶液pH=5,则c(OH-)=10-9mol/L,根据Ksp[Fe(OH)3]=3.5×10-38,Ksp[Mg(OH)2]=1.2×10-11,可计算出 c(Fe3+)、c(Mg2+)分别为3.5×10-11 mol/L、1.2×107 mol/L。
(4)根据Ksp[Al(OH)3]=1.0×10-33,可计算出溶液pH=5 时,c(Al3+)<1.0×10-5 mol/L,Al3+也几乎完全沉淀,故可能混有的杂质是Al(OH)3。Al(OH)3溶于强碱,而 Fe(OH)3 不溶,故可用NaOH溶液除去。
答案:(1)4Fe2++O2+4H+===4Fe3++2H2O 耗费少且无污染
12.钡(Ba)和锶(Sr)及其化合物在工业上有着广泛的应用,它们在地壳中常以硫酸盐的形式存在,BaSO4和SrSO4都是难溶性盐。工业上提取钡和锶时首先将BaSO4和SrSO4转化成难溶弱酸盐。
已知:SrSO4(s) 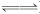 Sr2+(aq)+SO(aq) Ksp=2.5×10-7
Sr2+(aq)+SO(aq) Ksp=2.5×10-7
SrCO3(s)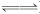 Sr2+(aq)+CO(aq) Ksp=2.5×10-9
Sr2+(aq)+CO(aq) Ksp=2.5×10-9
(1)将SrSO4转化成SrCO3的离子方程式为______________________________________,该反应的平衡常数表达式为__________________;该反应能发生的原因是________________________________________________________________________
_________________________________________(用沉淀溶解平衡的有关理论解释)。
(2)对于上述反应,实验证明增大CO的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”、“减小”或“不变”):
①升高温度,平衡常数K将________;
②增大CO的浓度,平衡常数K将________。
(3)已知,SrSO4和SrCO3在酸中的溶解性与BaSO4和BaCO3类似,设计实验证明上述过程中SrSO4是否完全转化成SrCO3。实验所用的试剂为________;实验现象及其相应结论为________________________________________________________________________
________________________________________________________________________。
解析:(1)SrSO4转化成SrCO3的离子反应为SrSO4(s)+CO(aq)SrCO3(s)+SO(aq),平衡常数表达式为K=,根据沉淀转化的原理,该反应能够发生,是因为Ksp(SrCO3)<Ksp(SrSO4)。(2)①降低温度有利于提高SrSO4的转化率,说明降温平衡向正反应方向移动,因此升高温度,平衡向逆反应方向移动,故平衡常数K减小。②平衡常数只与温度有关,增大CO的浓度,平衡常数不变。(3)根据提供的信息,可以推断SrSO4难溶于盐酸,而SrCO3可溶于盐酸,因此向溶液中加入盐酸,若沉淀全部溶解,则SrSO4完全转化成SrCO3,若沉淀没有全部溶解,则SrSO4没有完全转化成SrCO3,需要注意的是,不能选择稀硫酸,因为SrCO3与稀硫酸反应生成SrSO4。
答案:(1)SrSO4(s)+CO(aq) SrCO3(s)+SO(aq)
SrCO3(s)+SO(aq)
K= Ksp(SrCO3)<Ksp(SrSO4),加入CO后,平衡SrSO4(s) Sr2+(aq)+SO(aq)正向移动,生成SrCO3
Sr2+(aq)+SO(aq)正向移动,生成SrCO3
(2)①减小 ②不变
(3)盐酸 若沉淀完全溶解,则证明SrSO4完全转化成SrCO3,否则,未完全转化
二、非选择题
11.已知:25 ℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=1×10-9。
(1)医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂。胃酸酸性很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是(用溶解平衡原理解释)________________________________________________________________________
________________________________________________________________________。
万一误服了少量BaCO3,应尽快用大量0.5 mol/L Na2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为________mol/L。
(2)长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。
①CaSO4转化为CaCO3的离子方程式为_______________________________________。
②请分析CaSO4转化为CaCO3的原理:_________________________________。
解析:(1)BaSO4(s)Ba2+(aq)+SO(aq),由于Ba2+、SO均不与H+反应,无法使平衡移动。c(Ba2+)==2×10-10 mol/L。
答案:(1)对于平衡BaSO4(s)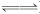 Ba2+(aq)+SO(aq),H+不能减少Ba2+或SO的浓度,平衡不能向溶解的方向移动 2×10-10
Ba2+(aq)+SO(aq),H+不能减少Ba2+或SO的浓度,平衡不能向溶解的方向移动 2×10-10
(2)①CaSO4(s)+CO(aq)===CaCO3(s)+SO(aq)
②CaSO4存在沉淀溶解平衡,加入Na2CO3溶液后,CO与Ca2+结合生成CaCO3沉淀,Ca2+浓度减小,使CaSO4的沉淀溶解平衡向溶解方向移动
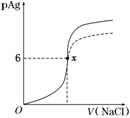
10.某温度时,Ag2SO4在水中的沉淀溶解曲线如图所示。该温度下,下列说法正确的是( )
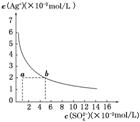
A.含有大量SO的溶液中肯定不存在Ag+
B.0.02 mol/L的AgNO3溶液与0.2 mol/L的Na2SO4溶液等体积混合不会生成沉淀
C.Ag2SO4的溶度积常数(Ksp)为1×10-3
D.a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点
解析:选B 由图知:Ksp(Ag2SO4)=(2×10-2)2×5×10-2=2×10-5,C错误;沉淀溶解平衡是动态平衡,故含有大量的SO的溶液中也含有少量的Ag+,A错误;两溶液等体积混合后c2(Ag+)·c(SO)=()2×=1×10-5<Ksp(Ag2SO4),因此不会产生Ag2SO4沉淀,B正确;a点为Ag2SO4的不饱和溶液,蒸发溶液,c(Ag+)和c(SO)都增大,故不能实现由a点到b点,D错误。
9.工业上采用湿法炼锌过程中,以ZnSO4为主要成分的浸出液中,含有Fe3+、Fe2+、Cu2+、Cl-等杂质,这些杂质对锌的电解工序有妨碍,必须事先除去。现有下列试剂可供选择:
①酸性KMnO4溶液 ②NaOH溶液 ③ZnO ④H2O2溶液
⑤Zn ⑥Fe ⑦AgNO3 ⑧Ag2SO4
下列说法不正确的是( )
A.用酸性KMnO4溶液将Fe2+氧化成Fe3+,再转化为Fe(OH)3沉淀除去
B.用ZnO调节浸出液的酸碱性,可使某些离子形成氢氧化物沉淀
C.在实际生产过程中,加入Ag2SO4可除去Cl-,是利用了沉淀转化的原理
D.也可以用ZnCO3代替ZnO调节溶液的酸碱性
解析:选A 用酸性KMnO4溶液氧化Fe2+时,会引入K+、Mn2+等新的杂质,这些离子在后续反应中难以除去,影响生产。生产中应该使用H2O2溶液氧化Fe2+,然后加入ZnO或ZnCO3调节溶液的pH,使Fe3+等离子形成沉淀。Ag2SO4的溶解度大于AgCl,所以用Ag2SO4除去Cl-利用了沉淀转化的原理。
8.(2014·宝鸡模拟)常温下,有关物质的溶度积如表所示。
|
物质 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
Mg(OH)2 |
Fe(OH)3 |
|
Ksp |
4.96×10-9 |
6.82×10-6 |
4.68×10-6 |
5.61×10-12 |
2.64×10-39 |
下列有关说法不正确的是( )
A.常温下,除去NaCl溶液中的MgCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
B.常温下,除去NaCl溶液中的CaCl2杂质,选用Na2CO3溶液比NaOH溶液效果好
C.向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+)∶c(Fe3+)=2.125×1021
D.无法利用Ca(OH)2制备NaOH
解析:选D A项中Ksp[Mg(OH)2]<Ksp[MgCO3],所以用NaOH溶液可使Mg2+沉淀更完全;同理可知B正确;C项中pH=8即c(OH-)=1×10-6 mol/L,当两种沉淀共存时,有=,代入数据,则有上述结果,C正确;D项可用下述反应实现:Ca(OH)2+Na2CO3===CaCO3↓+2NaOH,D错误。
7.(2014·嘉兴模拟)如图表示的是难溶氢氧化物在不同pH下的溶解度[S(mol/L)]。下列说法中正确的是( )
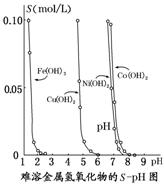
A.pH=3时溶液中铁元素的主要存在形式是Fe3+
B.若Ni(NO3)2溶液中含有少量的Co2+杂质,可通过调节溶液pH的方法来除去
C.若分离溶液中的Fe3+和Cu2+,可调节溶液的pH在4左右
D.若在含有Cu2+和Ni2+的溶液中加入烧碱,Ni(OH)2优先沉淀
解析:选C 当pH=3时,Fe3+已沉淀完全,A错误;由于Ni2+和Co2+完全沉淀时pH相差不大,故不宜采用调节溶液pH的方法来除去,B错误;根据图示可知在含有Cu2+和Ni2+的溶液中加入烧碱,Cu(OH)2优先沉淀,D错误。
6.化工生产中常用MnS作为沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s) CuS(s)+Mn2+(aq),下列说法错误的是( )
CuS(s)+Mn2+(aq),下列说法错误的是( )
A.MnS的Ksp比CuS的Ksp大
B.该反应达平衡时c(Mn2+)=c(Cu2+)
C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
D.该反应的平衡常数K=
解析:选B 根据沉淀转化向溶度积小的方向进行,Ksp(MnS)>Ksp(CuS),A正确;该反应达平衡时c(Mn2+)、c(Cu2+)保持不变,但不一定相等,B错误;往平衡体系中加入少量CuSO4固体后,平衡向正方向移动,c(Mn2+)变大,C正确;该反应的平衡常数K===,D正确。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com