
4.(2014·福州模拟)下列各组物质,具有相同的最简式,但既不属于同分异构体又不属于同系物的是( )
①聚乙烯和乙烯 ②乙酸和葡萄糖 ③淀粉和纤维素
④蔗糖和麦芽糖 ⑤聚乙烯和聚氯乙烯
A.①②④ B.①②③ C.③④⑤ D.②③⑤
解析:选B 解题的关键是正确理解同分异构体和同系物的概念。最简式相同的有①②③④四组,其中④蔗糖和麦芽糖的分子式相同,属于同分异构体。
3.下列营养物质在人体内发生的变化及其对人的生命活动所起的作用叙述不正确的是( )
A.淀粉水解葡萄糖氧化CO2和H2O(释放能量维持生命活动)
B.纤维素水解葡萄糖氧化CO2和H2O(释放能量维持生命活动)
C.油脂水解甘油和高级脂肪酸氧化CO2和H2O(释放能量维持生命活动)
D.蛋白质水解氨基酸合成人体所需的蛋白质(人体生长发育)
解析:选B 人体内不含消化纤维素的消化酶,因此纤维素无法水解成葡萄糖,故B错误。
2.糖类、油脂、蛋白质为动物性和植物性食物中的基本营养物质。下列说法正确的是( )
A.蛋白质中只含C、H、O三种元素
B.油脂在人体中发生水解的产物是氨基酸
C.牛油、大豆油的主要成分都是高级脂肪酸甘油酯
D.糖类、油脂、蛋白质一定都能发生水解反应
解析:选C A项,蛋白质中一定含有C、H、O、N四种元素,还可能含有S、P等其他元素;B项,油脂的水解产物为甘油和高级脂肪酸;D项,糖类中的单糖不能水解。
一、选择题
1.下列有关乙醇、乙酸的说法,错误的是( )
A.乙醇和乙酸都可以发生酯化反应
B.乙醇和乙酸都可以与钠反应生成氢气
C.乙醇和乙酸都能发生氧化反应
D.乙醇和乙酸都含有羟基,二者是同分异构体
解析:选D 乙醇含有羟基,乙酸含有羧基,二者都可以发生酯化反应,A正确;乙醇含有羟基,可以与钠反应生成氢气,乙酸含有羧基,可以与钠反应生成氢气,B正确;乙醇在铜作催化剂加热的条件下,可以被氧气氧化为乙醛,乙酸可以燃烧,发生氧化反应,C正确;乙醇和乙酸分子式不同,结构也不一样,二者不是同分异构体,D错误。
4.分别在pH=1的酸和pH=14的NaOH溶液中加入足量的铝,放出H2的量前者多,其原因可能是( )
①两溶液的体积相同,酸是多元强酸 ②两溶液的体积相同,酸是一元弱酸 ③酸溶液的体积大于NaOH溶液的体积 ④酸是强酸,浓度比NaOH溶液的大
A.①② B.②
C.②③ D.④
解析:选C 产生H2的量相等时,需n(H+)>n(OH-),题中酸产生H2多,则一定是n(H+)>n(OH-),而pH=1的酸中c(H+)与pH=14的NaOH溶液中c(OH-)相比要小,所以有两种情况可产生题设结果:一是等体积时,酸是弱酸,二是酸的体积大。
3.常温时,0.01 mol/L某一元弱酸的电离常数Ka=10-6,则下列说法正确的是( )
A.上述弱酸溶液的pH=4
B.加入NaOH溶液后,弱酸的电离平衡向右移动,Ka值增大
C.加入等体积0.01 mol/L NaOH溶液后,所得溶液的pH=7
D.加入等体积0.01 mol/L NaOH溶液后,所得溶液的pH<7
解析:选A 设该一元弱酸为HA:HA H++A-,则Ka===10-6,求得c(H+)=10-4 mol/L,故pH=4;B项中Ka值应不变,C、D项中pH>7。
H++A-,则Ka===10-6,求得c(H+)=10-4 mol/L,故pH=4;B项中Ka值应不变,C、D项中pH>7。
2.常温下,pH=12的氢氧化钠和pH=4的醋酸等体积混合后恰好中和,忽略混合后溶液体积的变化,下列说法中正确的是( )
A.混合前的醋酸约1%发生电离
B.混合后的溶液中c(Na+)=c(CH3COO-)
C.氢氧化钠和醋酸的浓度不相等
D.混合后的溶液呈中性
解析:选A 常温下,pH=12的氢氧化钠和pH=4的醋酸等体积混合后恰好中和,说明醋酸和氢氧化钠两溶液的浓度相等,即醋酸的初始浓度为0.01 mol/L,又因c(H+)=
10-4mol/L,故混合前的醋酸约1%发生电离,A正确,C错误;恰好中和生成醋酸钠溶液显碱性,D错误,根据电荷守恒,c(Na+)>c(CH3COO-),B错误。
1.在0.1 mol/L CH3COOH溶液中存在电离平衡:
CH3COOH CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A.加入水时,平衡向左移动
B.加入少量NaOH固体,平衡向右移动
C.加入少量0.1 mol/L HCl溶液,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向右移动
解析:选B A项,加入水时,溶液的浓度减小,电离程度增大,平衡向右移动;B项,加入的NaOH与H+反应,c(H+)变小,平衡向右移动;C项,加入0.1 mol/L HCl溶液时c(H+)变大,平衡向左移动,但最终c(H+)比未加HCl溶液前要大;D项,加入CH3COONa,c(CH3COO-)增大,平衡向左移动。
14.甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动。实验方案如下:
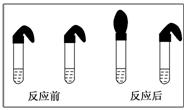
甲:取纯度相同,质量、大小相等的锌粒于两支试管中,同时加入 0.1 mol/L的HA溶液、稀盐酸各10 mL,按图装好,观察现象。
乙:①用pH计测定浓度均为0.1 mol/L的HA溶液和稀盐酸的pH;
②再取0.1 mol/L的HA溶液和稀盐酸各2滴(1滴约为1/20 mL)分别稀释至100 mL,再用pH计测其pH变化。
(1)乙的方案中说明HA是弱电解质的理由是:测得0.1 mol/L 的HA溶液的pH________1(填“>”、“<”或“=”);甲方案中,说明HA是弱电解质的实验现象是:________(填序号)。
A.加入两种稀酸后,两个试管上方的气球同时鼓起,且一样大
B.加入两种酸溶液后,HA溶液试管上方的气球鼓起慢
(2)乙同学设计的实验第________步,能证明改变条件弱电解质电离平衡发生移动。
(3)甲同学为了进一步证明弱电解质电离平衡移动的情况,设计如下实验:
①使HA的电离程度和c(H+)都减小,c(A-)增大,可在0.1 mol/L的HA溶液中,加入试剂________(填序号,下同);
②使HA的电离程度减小,c(H+)和c(A-)都增大,可在0.1 mol/L的HA溶液中,选择加入试剂________。
A.NaA固体(可完全溶于水)
B.1 mol/L NaOH溶液
C.1 mol/L H2SO4
D.2 mol/L HA
解析:(1)弱酸不能完全电离,故0.1 mol/L的HA中c(H+)必小于0.1 mol/L,故pH>1,因HA为弱酸,溶液中的c(H+)低于相同浓度的一元强酸的c(H+),故产生氢气的速率稍慢,但最终由于电离出的氢离子的量相同,故生成氢气的体积一样大,即气球的体积一样大。
(2)乙方案中②,取0.1 mol/L的HA溶液和稀盐酸各2滴,稀释相同的倍数,弱酸HA的pH变化小,强酸的pH变化大,这是因为稀释能促进弱电解质电离平衡的移动。
答案:(1)> B (2)② (3)①A ②D

13.(2014·济南模拟)25 ℃时,电离平衡常数:
|
化学式 |
CH3COOH |
H2CO3 |
HClO |
|
电离平衡常数 |
1.8×10-5 |
K1:4.3×10-7 K2:5.6×10-11 |
3.2×10-8 |
请回答下列问题:
(1)物质的量浓度为0.1 mol/L的下列四种物质:
a.Na2CO3 b.NaClO c.CH3COONa d.NaHCO3
pH由大到小的顺序是____________(填编号)。
(2)常温下0.1 mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变大的是________。
A.c(H+) B.
C.c(H+)·c(OH-) D.
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:________________________________________________________________________。
(4)25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=__________________(填准确数值)。
(5)25 ℃时,将a mol/L的醋酸与b mol/L氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为 __________________。
解析:(1)酸越弱,对应酸根离子的水解程度越大,所以pH由大到小的顺序是a>b>d>c。(2)常温下0.1 mol/L的CH3COOH溶液加水稀释过程中,CH3COOH的电离程度变大,c(H+)、c(CH3COO-)变小,c(OH-)变大,电离常数不变,c(H+)变小,c(H+)·c(OH-)不变,变大。==,一定变大。
(3)酸性强弱顺序为H2CO3>HClO>HCO,所以向次氯酸钠溶液中通入少量二氧化碳的离子方程式为:ClO-+CO2+H2O===HCO+HClO。
(4)25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得混合溶液pH=6,则c(H+)=10-6 mol/L,c(OH-)=10-8 mol/L,则溶液中c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=10-6mol/L-10-8mol/L=9.9×10-7 mol/L。
(5)25 ℃时,将a mol/L的醋酸与b mol/L氢氧化钠等体积混合,反应后溶液恰好显中性,此时c(H+)=c(OH-)=10-7 mol/L,c(CH3COO-)=c(Na+)= mol/L,剩余的c(CH3COOH)= mol/L,
则Ka== 。
答案:(1)a>b>d>c (2)B、D
(3)ClO-+CO2+H2O===HCO+HClO
(4)9.9×10-7 mol/L (5)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com