
8.已知:2H2(g)+O2(g)===2H2O(l)
ΔH=-571.6 kJ/mol
2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)
ΔH=-1 452 kJ/mol
H+(aq)+OH-(aq)===H2O(l)
ΔH=-57.3 kJ/mol
下列说法正确的是( )
A.H2(g)的燃烧热ΔH=-571.6 kJ/mol
B.H2SO4(aq)+Ba(OH)2(aq)===BaSO4(s)+H2O(l)ΔH=-57.3 kJ/mol
C.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
D.3H2(g)+CO2(g)===CH3OH(l)+H2O(l)
ΔH=+135.9 kJ/mol
解析:选C 燃烧热是指在25 ℃、101 kPa下,1 mol纯物质完全燃烧生成稳定氧化物时所放出的热量。A项中根据已知热化学方程式可知H2(g)的燃烧热ΔH=-285.8 kJ/mol,错误;B项中有BaSO4(s)生成,而生成BaSO4也是放热的,所以放出的热量比57.3 kJ多,即B项中的ΔH<-57.3 kJ/mol,错误;C项,1 g H2(g)完全燃烧放出的热量为 =142.9 kJ,1 g CH3OH(g)完全燃烧放出的热量 kJ≈22.7 kJ,所以同质量时,H2(g)放出热量多,正确;D项,由盖斯定律可知正确的热化学方程式应是3H2(g)+CO2(g)===CH3OH(l)+H2O(l) ΔH=-131.4 kJ/mol。
7.已知:常温下,0.01 mol/L MOH溶液的pH为10,MOH(aq)与H2SO4(aq)反应生成1 mol正盐的ΔH=-24.2 kJ/mol,强酸与强碱的稀溶液的中和热为ΔH=-57.3 kJ/mol。则MOH在水溶液中电离的ΔH为( )
A.-69.4 kJ/mol B.-45.2 kJ/mol
C.+69.4 kJ/mol D.+45.2 kJ/mol
解析:选D 依题意,MOH是弱碱:MOH(aq)+H+(aq)===M+(aq)+H2O(l) ΔH1=-12.1 kJ/mol①,H+(aq)+OH-(aq)===H2O(l) ΔH2=-57.3 kJ/mol②,根据盖斯定律,由①-②得:MOH(aq)===M+(aq)+OH-(aq) ΔH=(-12.1+57.3) kJ/mol=+45.2 kJ/mol。
6.一定条件下,充分燃烧一定量的丁烷放出热量161.9 kJ,经测定完全吸收生成的CO2需消耗5 mol/L的KOH溶液100 mL,恰好生成正盐,则此条件下热化学方程式:C4H10(g)+O2(g)===4CO2(g)+5H2O(g)的ΔH为( )
A.+2 590.4 kJ/mol B.-2 590.4 kJ/mol
C.+1 295.2 kJ/mol D.-1 295.2 kJ/mol
解析:选B n(KOH)=5 mol/L×0.1 L=0.5 mol由2KOH+CO2===K2CO3+H2O知:n(CO2)=×0.5 mol=0.25 mol,即丁烷的物质的量为:0.25 mol×= mol,由题意知: mol丁烷燃烧放热161.9 kJ,故1 mol丁烷燃烧放热161.9 kJ÷=2 590.4 kJ,即ΔH=-2 590.4 kJ/mol。
5.根据以下三个热化学方程式:
2H2S(g)+3O2(g)===2SO2(g)+2H2O(l) ΔH=-Q1 kJ/mol,
2H2S(g)+O2(g)===2S(s)+2H2O(l) ΔH=-Q2 kJ/mol,
2H2S(g)+O2(g)===2S(s)+2H2O(g) ΔH=-Q3 kJ/mol。
判断Q1、Q2、Q3三者关系正确的是( )
A.Q1>Q2>Q3 B.Q1>Q3>Q2
C.Q3>Q2>Q1 D.Q2>Q1>Q3
解析:选A ①2H2S(g)+3O2(g)===2SO2(g)+2H2O(l)
ΔH1=-Q1 kJ/mol
②2H2S(g)+O2(g)===2S(s)+2H2O(l)
ΔH2=-Q2 kJ/mol
③2H2S(g)+O2(g)===2S(s)+2H2O(g)
ΔH3=-Q3 kJ/mol
由得:S(s)+O2(g)===SO2(g)
ΔH=(ΔH1-ΔH2)<0,
所以(-Q1+Q2)<0,即Q1>Q2。
由得:H2O(g)===H2O(l)
ΔH=(ΔH2-ΔH3)<0,
所以(-Q2+Q3)<0,即Q2>Q3。
故Q1>Q2>Q3。
4.下列关于反应能量的说法正确的是( )
A.Zn(s)+CuSO4(aq)===ZnSO4(aq)+Cu(s) ΔH=-216 kJ/mol,反应物总能量<生成物总能量
B.相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol 氢分子的能量为E2,则2E1>E2
C.101 kPa时,2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ/mol,H2的燃烧热ΔH= -241.8 kJ/mol
D.H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol,含1 mol NaOH的氢氧化钠溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ 的热量
解析:选B 放热反应,生成物的总能量<反应物总能量,A错误;氢气的燃烧热是指1 mol氢气完全燃烧生成稳定的氧化物(液态水)所放出的热量,题中是氢气燃烧生成气态水放出的热量,C错误;中和热是指稀酸与稀碱反应的放热,浓硫酸稀释本身就可以放出大量的热量,D错误。
3.对热化学方程式C(s)+H2O(g)===CO(g)+H2(g)
ΔH=+131.3 kJ/mol最准确的理解是( )
A.碳和水反应吸收131.3 kJ热量
B.1 mol碳和1 mol水反应生成一氧化碳和氢气,同时放出131.3 kJ热量
C.1 mol碳和1 mol水蒸气反应生成1 mol CO和1 mol H2,同时吸收131.3 kJ热量
D.1个固态碳原子和1分子水蒸气反应吸收131.1 kJ热量
解析:选C 热化学方程式的系数表示物质的量,A、D错误;B的说法不准确,未强调“水蒸气”,且应为吸收热量。
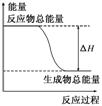
2.下列物质间的反应,其能量变化符合图示的是( )
A.由Zn和稀H2SO4制氢气
B.灼热的炭粉与二氧化碳反应
C.Ba(OH)2·8H2O晶体和NH4Cl晶体混合
D.碳酸钙的分解
解析:选A 该图示为放热反应能量图,A为典型放热反应,B、C是教材知识点,是吸热反应的典型代表,D项反应条件是高温,需持续加热,是吸热反应。
一、选择题
1.(2014·济南模拟)下列说法中正确的是( )
A.在化学反应过程中,发生物质变化的同时不一定发生能量变化
B.破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时,该反应为吸热反应
C.生成物的总焓大于反应物的总焓时,反应吸热,ΔH>0
D.ΔH的大小与热化学方程式的化学计量数无关
解析:选C 化学反应中一定有能量变化,A错误;B项,由ΔH=断开旧化学键吸收的能量-形成新化学键放出的能量,得ΔH<0,故为放热反应。
2.碳、氧、氯、铁是与人类生产、生活息息相关的化学元素。
(1)基态铁原子的核外电子排布式为____________________________________________。
(2)C、O、Cl三种元素的电负性由大到小的顺序为________(用元素符号表示)。COCl2俗称光气,分子中C原子采取________杂化成键,根据原子轨道重叠方式的不同来看,碳原子与氧原子之间形成共价键的类型和数目为______________。
(3)甲烷和四氯化碳具有相似的空间结构,但常温下甲烷是气体,四氯化碳是液体,其原因是________________________________________________________________________。
解析:(1)铁原子的核电荷数为26,依据核外电子排布规律可知基态铁原子的核外电子排布式为1s22s22p63s23p63d64s2。
(2)COCl2分子中,中心原子C价层电子对数为3,故杂化类型为sp2;在C===O键中,含1个σ键、1个π键。
答案:(1)1s22s22p63s23p63d64s2 (2)O>Cl>C sp2 1个σ键、1个π键 (3)组成和结构相似的分子晶体,相对分子质量越大,分子间作用力(或范德华力)越强,沸点越高
1.Q、R、X、Y、Z五种元素的原子序数依次增加。已知:①Z的原子序数为29,其余均为短周期主族元素;②Y原子的价电子(外围电子)排布式为msnmpn;③R原子核外L层上的电子数为奇数;④Q、X原子p轨道的电子数分别为2和4。请回答下列问题:
(1)Z2+的核外电子排布式是______________________________________________。
(2)在[Z(NH3)4]2+中,Z2+的空轨道接受NH3分子提供的________形成配位键。
(3)Q和Y形成的最简单氢化物分别为甲、乙,下列判断正确的是________。
a.稳定性:甲>乙,沸点:甲>乙
b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙
d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、X三种元素的第一电离能数值由小到大的顺序为________(用元素符号作答)。
(5)Q的一种氢化物的相对分子质量为26,其分子中σ键与π键的数目之比为________。
解析:(1)原子序数为29的元素为Cu,故Cu2+(核外有27个电子)的核外电子排布式为1s22s22p63s23p63d9。
(2)形成配位键时,中心离子提供空轨道接受配体提供的孤电子对。
(3)由Y原子价电子排布式与s轨道容纳电子数的特点可知Y为第ⅣA族元素;利用R的核外电子排布特点可知R为第二周期奇数族的元素;利用Q、X原子p轨道的电子数可知Q、X分别为C、O,则R为氮元素,Y只能是硅元素。CH4与SiH4为结构相似的分子,因非金属性:C>Si,故稳定性:CH4>SiH4;因SiH4的相对分子质量较CH4大,分子间作用力较大,故沸点:CH4<SiH4。
(4)由于N的p能级电子处于半充满状态,故第一电离能反常高于O,因此第一电离能:C<O<N。
(5)相对分子质量为26的碳氢化合物是C2H2,分子中含有3个σ键和2个π键。
答案:(1)1s22s22p63s23p63d9 (2)孤对电子(或孤电子对)
(3)b (4)C<O<N (5)3∶2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com