
5.已知:
①H2O(g)===H2O(l) ΔH=-Q1 kJ/mol
②C2H5OH(g)===C2H5OH(l) ΔH=-Q2 kJ/mol
③C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g)
ΔH=-Q3 kJ/mol
下列判断正确的是( )
A.酒精的燃烧热为Q3 kJ
B.若使23 g液态酒精完全燃烧,最后恢复到室温,释放出的热量为(1.5Q1-0.5Q2+0.5Q3) kJ
C.H2O(g)→H2O(l)释放出了热量,所以该过程为化学变化
D.由反应③可知1 mol C2H5OH(g)的能量高于2CO2(g)和3H2O(g)的总能量
解析:选B 要确定C2H5OH的燃烧热必须确定C2H5OH燃烧生成液态H2O的热化学方程式,根据目标反应可将3个反应进行加减,即③-②+①×3,故燃烧热ΔH=-Q3 kJ/mol-(-Q2 kJ/mol)+(-Q1 kJ/mol)×3=-(Q3-Q2+3Q1) kJ/mol,A错误;23 g酒精的物质的量为=0.5 mol,故B项中释放的热量为0.5×(Q3-Q2+3Q1)kJ,B正确;状态变化属于物理变化,C错误;D项,应该是反应物的总能量高于生成物的总能量,D错误。
4.25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2 800 kJ/mol,则下列热化学方程式正确的是( )
A.C(s)+O2(g)===CO(g) ΔH=-393.5 kJ/mol
B.2H2(g)+O2(g)===2H2O(g) ΔH=+571.6 kJ/mol
C.CH4(g)+2O2 (g)===CO2 (g)+2H2O(g) ΔH=-890.3 kJ/mol
D.C6H12O6(s)+3O2(g)===3CO2 (g)+3H2O(l) ΔH=-1 400 kJ/mol
解析:选D 根据燃烧热的定义,碳的燃烧产物应是二氧化碳;氢气燃烧是放热反应(ΔH<0)且生成液态水;25 ℃时,甲烷的燃烧产物是气态二氧化碳和液态水。
3.高温下,在密闭容器中用H2还原WO2可得到金属钨,其总反应为WO2(s)+2H2(g)===W(s)+2H2O(g) ΔH=+66.0 kJ/mol;又已知WO2(g)+2H2(g)===W(s)+2H2O(g)
ΔH=-137.9 kJ/mol,下列判断正确的是( )
A.总反应中,反应物能量总和大于生成物能量总和
B.W(s)+2H2O(l)===WO2(s)+2H2(g) ΔH=-66.0 kJ/mol
C.总反应中生成1 mol W(s)放出66.0 kJ热量
D.WO2(s)===WO2(g)的ΔH=+203.9 kJ/mol
解析:选D 由题中信息知用H2还原WO2,得到金属钨为吸热反应,故可判知反应物总能量小于生成物总能量,同时知生成1 mol W(s)时需吸收66.0 kJ的热量,A、C错误;B项中H2O的状态符号应为“g”,B错误。
2.氧气(O2)和臭氧(O3)是氧元素的两种同素异形体,已知热化学方程式:
4Al(s)+3O2(g)===2Al2O3(s) ΔH1①
4Al(s)+2O3(g)===2Al2O3(s) ΔH2②
3O2(g)===2O3(g) ΔH3③
则( )
A.ΔH1-ΔH2=ΔH3 B.ΔH1+ΔH2=ΔH3
C.ΔH2-ΔH1=ΔH3 D.ΔH1+ΔH2+ΔH3=0
解析:选A 根据盖斯定律可知,①-②=③,所以ΔH1-ΔH2=ΔH3。
1.下列说法正确的是( )
A.已知a g乙烯气体充分燃烧时生成1 mol CO2和液态水,放出b kJ的热量,则表示乙烯燃烧热的热化学方程式为2C2H4(g)+6O2(g)===4CO2(g)+4H2O(l) ΔH=-4b kJ/mol
B.已知:H2(g)+F2(g)===2HF(g) ΔH=-270 kJ/mol,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ
C.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)500 ℃30 MPa2NH3(g) ΔH=-38.6 kJ/mol
D.已知:①C(s,石墨)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol,②C(s,金刚石)+O2(g)===CO2(g) ΔH=-395.0 kJ/mol,则C(s,金刚石)===C(s,石墨) ΔH=-1.5 kJ/mol
解析:选D 表示乙烯燃烧热的热化学方程式中C2H4(g)的化学计量数应为1,A错误;气体变为液体时要放出热量,所以1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量大于270 kJ,B错误;此反应为可逆反应,投入0.5 mol的氮气,最终参加反应的氮气一定小于0.5 mol,因此热化学方程式中ΔH应大于-38.6 kJ/mol,C错误;D中由②-①可知正确。
13.碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如下: ΔH=+88.6 kJ/mol则M、N相比,较稳定的是________。
ΔH=+88.6 kJ/mol则M、N相比,较稳定的是________。
(2)已知CH3OH(l)的燃烧热ΔH=-238.6 kJ/mol,CH3OH(l)+O2(g)===CO2(g)+2H2(g) ΔH=-a kJ/mol,则a________238.6(填“>”、“<”或“=”)。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:___________________________________________。
(4)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)===2Al2O3(s)+3TiC(s) ΔH=-1 176 kJ/mol,则反应过程中,每转移1 mol电子放出的热量为________。
解析:(1)M转化为N是吸热反应,所以N的能量高,不稳定。(2)甲醇燃烧生成CO2(g)和H2(g)属于不完全燃烧,放出的热量少,故a<238.6。(3)反应的化学方程式为2Cl2(g)+2H2O(g)+C(s)===4HCl(g)+CO2(g),当有2 mol Cl2参与反应时释放出290 kJ热量,所以该反应的热化学方程式为2Cl2(g)+2H2O(g)+C(s)===4HCl(g)+CO2(g) ΔH=-290 kJ/mol。(4)所给反应中转移12个电子,故每转移1 mol电子放出的热量为1 176 kJ÷12=98 kJ。
答案:(1)M (2)<
(3)2Cl2(g)+2H2O(g)+C(s)===4HCl(g)+CO2(g) ΔH=-290 kJ/mol (4)98 kJ

12.(2014·运城模拟)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用 kJ/mol 表示。如图为某反应过程中的能量变化,回答问题。
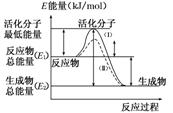
(1)图中所示的反应是__________(填“吸热”或“放热”)反应,该反应的ΔH=______(用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+O2(g)===H2O(g) ΔH=-241.8 kJ/mol,该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为__________。
(3)对于同一反应,图中过程(Ⅱ)与过程(Ⅰ)相比,反应速率加快,你认为可能的原因是________________________________________________________________________。
(4)通常把拆开1 mol化学键所吸收的热量看成该化学键的键能。已知部分化学键的键能如表所示:
|
化学键 |
N—H |
N—N |
O===O |
N≡N |
O—H |
|
键能(kJ/mol) |
386 |
167 |
498 |
946 |
460 |
发射神舟飞船的长征火箭用了肼(N2H4,气态)为燃料,试写出它在氧气中燃烧生成了N2和气态水的热化学方程式____________________________________________________。
解析:(1)根据图像可知,生成物总能量比反应物总能量低,反应为放热反应,ΔH=E2-E1。
(2)逆反应的活化能为167.2 kJ/mol-(-241.8 kJ/mol)=-409.0 kJ/mol。
(3)Ⅱ线和Ⅰ线相比,反应速率加快,反应的活化能降低,可能是加入了催化剂。
(4)反应的化学方程式为N2H4(g)+O2(g)===N2(g)+2H2O(g),ΔH=E(O—O)+E(N—N)+4E(N—H)-E(N≡N)—4E(O—H)=-577 kJ/mol。
答案:(1)放热 E2-E1 (2)409.0 kJ/mol
(3)加入了催化剂
(4)N2H4(g)+O2(g)===N2(g)+2H2O(g)
ΔH=-577 kJ/mol
二、非选择题
11.当前能源危机是一个全球性问题,开源节流是应对能源危机的重要举措。
(1)下列做法有利于能源“开源节流”的是______ (填字母)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料
d.减少资源消耗,加大资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。

①在通常状况下,金刚石和石墨相比较,________(填“金刚石”或“石墨”)更稳定,石墨的燃烧热ΔH=________。
②12 g石墨在一定量空气中燃烧,生成气体36 g,该过程放出的热量为________。
(3)已知:N2、O2分子中化学键的键能分别是946 kJ/mol、497 kJ/mol。
N2(g)+O2(g)===2NO(g) ΔH=+180.0 kJ/mol。
NO分子中化学键的键能为________ kJ/mol。
(4)综合上述有关信息,请写出用CO除去NO的热化学方程式:________________________________________________________________________。
解析:(1)通过分析只有b项不利于能源“开源节流”。
(2)①石墨的能量较低,更稳定。石墨的燃烧热指1 mol石墨完全燃烧生成CO2时放出的热量。②12 g石墨和24 g氧气反应,即1 mol C和0.75 mol O2反应,则生成0.5 mol CO和0.5 mol CO2,放出的热量为0.5 mol×110.5 kJ/mol+0.5 mol×393.5 kJ/mol=252.0 kJ。
(3)ΔH=E(N2)+E(O2)-2E(NO),2E(NO)=946 kJ/mol+497 kJ/mol-180.0 kJ/mol,E(NO)=631.5 kJ/mol。
(4)已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566.0 kJ/mol,N2(g)+O2(g)===2NO(g) ΔH=+180.0 kJ/mol,目标反应 2NO(g)+2CO(g)===N2(g)+2CO2(g)可由两个反应相减获得,则ΔH=-746.0 kJ/mol。
答案:(1)a、c、d
(2)①石墨 -393.5 kJ/mol ②252.0 kJ
(3)631.5
(4)2NO(g)+2CO(g)===N2(g)+2CO2(g)
ΔH=-746.0 kJ/mol
10.生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12 000~20 000倍,在大气中的寿命可长达740年之久,表中是几种化学键的键能:
|
化学键 |
N≡N |
F—F |
N—F |
|
1 mol分子中的化学键断裂时需要吸收的能量/kJ |
941.7 |
154.8 |
283.0 |
下列说法中正确的是( )
A.过程N2(g)―→2N(g)放出能量
B.过程N(g)+3F(g)―→NF3(g)放出能量
C.反应N2(g)+3F2(g)===2NF3(g)的ΔH>0
D.NF3吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应
解析:选B 化学键的断裂需要吸收能量,化学键的形成要放出能量,两个过程的总体热效应是反应热。断键的过程吸收能量,A错误;成键的过程放出能量,B正确;C项,反应的ΔH=反应物的键能之和-生成物的键能之和=941.7 kJ/mol+3×154.8 kJ/mol-6×283.0 kJ/mol=-291.9 kJ/mol,C错误;若NF3吸收能量后没有化学键的断裂与形成,则是物理变化,化学反应过程中必有化学键的断裂与形成,D错误。
9.甲醇质子交换膜在燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g)
ΔH1=+49.0 kJ/mol
②CH3OH(g)+O2(g)===CO2(g)+2H2(g)
ΔH2=-192.9 kJ/mol
根据上述反应,下列说法正确的是( )

A.反应①中的能量变化如图所示
B.CH3OH转变成H2的过程一定要吸收能量
C.1 mol CH3OH充分燃烧放出的热量为192.9 kJ
D.可推知2H2(g)+O2(g)===2H2O(g)ΔH=-483.8 kJ/mol
解析:选D A项,反应①为吸热反应,图示能量变化关系错误;B项,从题中反应①②来看,CH3OH转变成H2可能吸热,也可能放热;反应②中生成物H2可以继续燃烧,即1 mol CH3OH充分燃烧放出的热量要大于192.9 kJ;根据盖斯定律可判断D正确。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com