
5.某温度下,在一个2 L的密闭容器中,加入4
mol A和 2 mol B进行如下反应:3A(g)+2B(g) 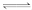 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )
A.该反应的化学平衡常数表达式是K=
B.此时,B的平衡转化率是40%
C.增大该体系的压强,化学平衡常数增大
D.增加B,B的平衡转化率增大
解析:选B 化学平衡常数的表达式中不能出现固体或纯液体,而物质C是固体,A错误;根据化学方程式可知,平衡时减少的B的物质的量是1.6 mol×=0.8 mol,所以B的转化率为×100%=40%,B正确;平衡常数只与温度有关,增大压强时平衡常数不变,C错误;增加B后平衡右移,A的转化率增大,而B的转化率减小,D错误。
4.(2014·济南高三质检)可逆反应:2SO2+O2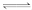 2SO3达到平衡状态时,保持恒温恒容向容器中加入一定量的O2。下列说法正确的是(K为平衡常数,Qc为浓度商)( )
2SO3达到平衡状态时,保持恒温恒容向容器中加入一定量的O2。下列说法正确的是(K为平衡常数,Qc为浓度商)( )
A.Qc不变,K变大,O2转化率增大
B.Qc不变,K变大,SO2转化率减小
C.Qc变小,K不变,O2转化率减小
D.Qc增大,K不变,SO2转化率增大
解析:选C 当可逆反应2SO2+O2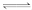 2SO3达到平衡状态时,保持恒温恒容向容器中加入一定量的O2,平衡向右进行,但O2转化率减小,浓度商Qc变小,K不变。
2SO3达到平衡状态时,保持恒温恒容向容器中加入一定量的O2,平衡向右进行,但O2转化率减小,浓度商Qc变小,K不变。
3.化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数的数值如下:
2NO(g) N2(g)+O2(g) K1=1×1030;
N2(g)+O2(g) K1=1×1030;
2H2(g)+O2(g) 2H2O(g) K2=2×1081;
2H2O(g) K2=2×1081;
2CO2(g) 2CO(g)+O2(g) K3=4×10-92。
2CO(g)+O2(g) K3=4×10-92。
以下说法正确的是( )
A.常温下,NO分解产生O2的反应的平衡常数表达式为K1=c(N2)·c(O2)
B.常温下,水分解产生O2,此时平衡常数的数值约为5×10-80
C.常温下,NO、H2O、CO2三种化合物分解放出O2的倾向由大到小的顺序为NO>H2O>CO2
D.以上说法都不正确
解析:选C K1的表达式应为K1=,A错误;常温下,水分解产生O2,是H2和O2化合生成H2O的逆反应,因此其平衡常数的数值应为K2的倒数,数值为5×10-82,B错误;由于三个反应都处在常温下,根据K值的大小可以得出三种化合物分解放出O2的倾向由大到小的顺序为NO>H2O>CO2,C正确。
2.下列说法正确的是( )
A.凡是放热反应都是自发的,因为吸热反应都是非自发的
B.自发反应的熵一定增大,非自发反应的熵一定减小
C.常温下,反应C(s)+CO2(g) 2CO(g)不能自发进行,则该反应的ΔH>0
2CO(g)不能自发进行,则该反应的ΔH>0
D.反应2Mg(s)+CO2(g)===C(s)+2MgO(s)能自发进行,则该反应的ΔH>0
解析:选C 反应的自发性是由熵变和焓变共同决定的。若ΔH<0,ΔS>0,则一定能够自发进行;若ΔH>0,ΔS<0,则一定不能自发进行;若ΔH<0,ΔS<0或ΔH>0,ΔS>0,反应能否自发进行,和温度有关,A、B错误;C项中反应的ΔS>0,若ΔH<0,则一定能够自发进行,现常温下不能自发进行,说明ΔH>0,正确;D项中反应的ΔS<0,能自发进行,说明ΔH<0,错误。
一、选择题
1.下列关于平衡常数的说法正确的是( )
A.在平衡常数表达式中,反应物浓度用起始浓度,生成物浓度用平衡浓度
B.在任何条件下,化学平衡常数是一个恒定值
C.平衡常数的大小与温度、浓度、压强、催化剂等无关
D.从平衡常数的大小可以推断一个反应进行的程度
解析:选D 在平衡常数表达式中,反应物及生成物浓度均为达到化学平衡时的浓度;在温度一定时,对一个确定化学计量数的可逆反应,化学平衡常数是一个恒定值,其大小只与温度有关,与其他外界条件无关,平衡常数的大小反映了化学反应可能进行的程度。
10.到目前为止,由化学能转变为热能或电能仍然是人类使用最主要的能源。
(1)化学反应中放出的热能(焓变,ΔH)与反应物和生成物在反应过程中断键和形成新键过程中吸收和放出能量的大小有关。
已知:H2(g)+Cl2(g)===2HCl(g) ΔH=-185 kJ/mol,断裂1 mol H—H键吸收的能量为436 kJ,断裂1 mol Cl—Cl键吸收的能量为247 kJ,则形成1 mol H—Cl键放出的能量为________。
(2)燃料燃烧将其所含的化学能转变为我们所需要的热能。已知:
①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ/mol
②C(s,石墨)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
③2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol
标准状况下22.4 L氢气和甲烷的混合气体在足量的氧气中充分燃烧反应放出588.05 kJ的热量,原混合气体中氢气的质量是________。根据以上三个热化学方程式,计算C(s,石墨)+2H2(g)===CH4(g)的反应热ΔH为________。
解析:(1)H2(g)+Cl2(g)===2HCl(g) ΔH=-185 kJ/mol,该反应的ΔH=旧键断裂吸收的能量-新键形成放出的能量,设形成1 mol H—Cl键放出的能量为x,则每发生这样的反应1 mol,ΔH=436 kJ/mol+247 kJ/mol-2x=-185 kJ/mol,解得x=434 kJ/mol,所以每形成1 mol H—Cl键放出434 kJ的热量。
(2)设混合气体中CH4的物质的量为a,H2的物质的量为b,a+b=1 mol,890.3 kJ/mol×a+571.6 kJ/mol×b/2=588.05 kJ,解得a=0.5 mol,b=0.5 mol,所以H2的质量为0.5 mol×2 g/mol=1.0 g。
根据反应C(s,石墨)+2H2(g)===CH4(g)可知,②+③-①即得,所以该反应的反应热为ΔH=-571.6 kJ/mol-393.5 kJ/mol+890.3 kJ/mol=-74.8 kJ/mol。
答案:(1)434 kJ (2)1.0 g -74.8 kJ/mol
9.(1)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)===N2O4 (l)
ΔH1=-19.5 kJ/mol
②N2H4(l)+O2(g)=== N2(g)+2H2O(g)
ΔH2=-534.2 kJ/mol
写出肼和N2O4 反应的热化学方程式:
________________________________________________________________________。
(2)碘也可用作心脏起搏器电源——锂碘电池的材料,该电池反应为:2Li(s)+I2(s)===2LiI(s) ΔH。
已知:4Li(s)+O2(g)===2Li2O(s) ΔH1;
4LiI(s)+O2(g)===2I2(s)+2Li2O(s) ΔH2。
则电池反应的ΔH=______________;碘电极作为该电池的________极。
(3)已知:温度过高时,WO2(s)转变为WO2(g):
WO2(s)+2H2(g)W(s)+2H2O(g)
ΔH=+66.0 kJ/mol
WO2(g)+2H2(g)W(s)+2H2O(g)
ΔH=-137.9 kJ/mol
则WO2(s)WO2(g)的ΔH=________________。
(4)铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
真空碳热还原-氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)===3AlCl(g)+3CO(g)
ΔH=a kJ/mol
3AlCl(g)===2Al(l)+AlCl3(g) ΔH=b kJ/mol
则反应Al2O3(s)+3C(s)===2Al(l)+3CO(g)的ΔH=________ kJ/mol(用含a、b的代数式表示)。
解析:(1)肼与N2O4反应生成N2和水蒸气:2N2H4+N2O4===3N2+4H2O,观察已知的两个热化学方程式运用盖斯定律可知,②×2-①得:2N2H4(l)+N2O4(l)===3N2(g)+4H2O(g) ΔH=ΔH2×2-ΔH1=-1 048.9 kJ/mol。
(2)直接运用盖斯定律,前式减去后式,然后除以2得:
ΔH=(ΔH1-ΔH2)/2;I2在反应中得到电子,为正极。
(3)根据题意可知,反应①WO2(s)+2H2(g)W(s)+2H2O(g) ΔH=+66.0 kJ/mol和②WO2(g)+2H2(g)W(s)+2H2O(g) ΔH=-137.9 kJ/mol,①-②可得WO2(s)WO2(g) ΔH=+203.9 kJ/mol。
(4)将题给的两个热化学方程式相加,即可得到所要求的热化学方程式,ΔH也随之相加即可。
答案:(1)2N2H4(l)+N2O4(l)===3N2(g)+4H2O(g)
ΔH=-1 048.9 kJ/mol (2)(ΔH1-ΔH2)/2 正
(3)+203.9 kJ/mol (4)a+b
8.判断正误,正确的划“√”,错误的划“×”
(1)开发核能、太阳能等新能源,推广甲醇汽油,使用无磷洗涤剂,都可直接降低碳排放。( )
(2)使用太阳能热水器、沼气的利用、玉米制乙醇都涉及到生物质能的利用。( )
(3)石油、煤、天然气、可燃冰、植物油都属于化石燃料。( )
解析:(1)使用无磷洗涤剂不能直接降低碳排放。
(2)太阳能热水器不涉及生物质能的利用。
(3)植物油不属于化石燃料。
答案:(1)× (2)× (3)×
7.实验测得:101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2,放出890.3 kJ的热量。下列热化学方程式的书写正确的是 ( )
①CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH=+890.3 kJ/mol
②CH4(g)+2O2(g)===CO2(g)+2H2O(l)
ΔH=-890.3 kJ/mol
③CH4(g)+2O2(g)===CO2(g)+2H2O(g)
ΔH=-890.3 kJ/mol
④2H2(g)+O2(g)===2H2O(l)ΔH=-571.6 kJ/mol
A.仅有② B.仅有②④
C.仅有②③④ D.全部符合要求
解析:选B 写热化学方程式时要重点注意其与普通化学方程式不同的几点:(1)产物的稳定状态,H2O为液态,C的稳定化合物为CO2;(2)单位是 kJ/mol,不是kJ;(3)数值,ΔH的数值要与方程式中计量系数保持一致;(4)符号,吸热用“+”,放热用“-”。仅②④符合要求。
6.下列热化学方程式或叙述正确的是( )
A.1 mol液态肼在足量氧气中完全燃烧生成水蒸气,放出642 kJ的热量:N2H4(l)+O2(g)===N2(g)+2H2O(g)
ΔH=+642 kJ/mol
B.12 g石墨转化为CO时,放出110.5 kJ的热量:2C(石墨,s)+O2(g)===2CO(g) ΔH=-110.5 kJ/mol
C.已知:H2(g)+O2(g)===H2O(l) ΔH=-286 kJ/mol,则:2H2O(l)===2H2(g)+O2(g)的ΔH=+572 kJ/mol
D.已知N2(g)+3H2(g)===2NH3(g) ΔH=-92.4 kJ/mol,则在一定条件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应放出46.2 kJ的热量
解析:选C A项,放热反应,ΔH<0,错误;B项,12 g C的物质的量为1 mol,选项中反应的焓变应为ΔH=-221.0 kJ/mol,错误;C项,已知反应为放热,则其逆反应为吸热,ΔH为“+”,ΔH与化学计量数成正比,正确;D项,反应是可逆反应,0.5 mol N2和1.5 mol H2不能完全反应,错误。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com