
1.某温度下,将2 mol A和3 mol B充入一密闭容器中,发生反应:aA(g)+B(g) C(g)+D(g),5 min后达到平衡,已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则( )
C(g)+D(g),5 min后达到平衡,已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则( )
A.a=3 B.a=2
C.B的转化率为40% D.B的转化率为60%
解析:选C 温度不变,扩大容器体积(相当于减小压强)时,A的转化率不变,说明反应前后气体的体积不变,即a=1,A、B错误;设达到平衡时,B的转化量为x mol,则A、B、C、D的平衡量分别为(2-x) mol、(3-x) mol、x mol、x mol,设容器体积为1 L,则平衡常数K=1=,解得x=1.2,B的转化率=1.2÷3×100%=40%,所以C正确,D错误。
14.甲醇(CH3OH)是一种重要的化工原料,合成甲醇的主要反应为CO(g)+2H2(g)  CH3OH(g),反应过程中的能量变化如图所示。
CH3OH(g),反应过程中的能量变化如图所示。
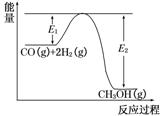
(1)CO(g)+2H2(g)  CH3OH(g) ΔH________0(填“<”、“=”或“>”)。
CH3OH(g) ΔH________0(填“<”、“=”或“>”)。
(2)在一定条件下,上述反应在一密闭容器中达到平衡。该反应平衡常数的表达式为________________________________________________________________________;
结合该表达式分析,在保证H2浓度不变的情况下,增大容器的压强,平衡________(填字母)。
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
(3)如图表示该反应在某一时间段中反应速率与时间的关系(t2、t4、t5时刻改变的条件都只有一个,且各不相同)。各阶段对应的平衡常数如图表所示:
|
t1~t2 |
t3~t4 |
t4~t5 |
t6~t7 |
|
K1 |
K2 |
K3 |
K4 |
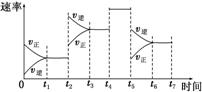
由此可判断各平衡常数之间的大小关系为________(用“>”、“<”或“=”连接)。
解析:(1)由题图可知,生成物的能量低于反应物,所以反应为放热反应。(2)在一密闭容器中,在保证H2浓度不变的情况下,增大容器的压强,因为H2浓度不变,根据表达式知体系内其他组分浓度也不变,正逆反应速率也不会变化,故平衡不移动。(3)分析图像:t2时刻改变条件后,v正、v逆都增大,且v逆>v正,平衡逆向移动(向吸热方向移动),综合影响化学反应速率和化学平衡的主要因素可知:t2时刻所改变的条件是升高温度,由平衡常数的表达式可知,平衡逆向移动,平衡常数变小,故K1>K2;t4时刻改变条件,正逆反应速率都增大,但平衡不移动,故t4时刻所改变的条件是使用催化剂,平衡常数不变,K3=K2;t5时刻改变条件,正逆反应速率都减小,且v逆>v正,平衡逆向移动,分析知:改变的条件是降低压强,因平衡常数是温度的函数,温度不变,平衡常数不变化,故K4=K3,综合知:K1>K2=K3=K4。
答案:(1)< (2)K= C
(3)K1>K2=K3=K4

13.(2014·湖北模拟)已知:
①溶液中CrO显黄色,Cr2O显橙红色;
②PbCrO4难溶于水,也难溶于强酸;
③H+(aq)+OH-(aq)=H2O(l) ΔH=-a kJ/mol;
④3Cl2(g)+2Cr3+(aq)+16OH-(aq)===2CrO(aq)+6Cl-(aq)+8H2O(l) ΔH=-b kJ/mol;
⑤2CrO(aq)+H+(aq) Cr2O(aq)+H2O(l) ΔH=-c kJ/mol,平衡常数K=9.5×104。(a、b、c均大于0)
Cr2O(aq)+H2O(l) ΔH=-c kJ/mol,平衡常数K=9.5×104。(a、b、c均大于0)
对上述反应③,取50 mL溶液进行试验,部分测定数据如表:
|
时间(s) |
0 |
0.01 |
0.02 |
0.03 |
0.04 |
|
n(CrO)/mol |
0.01 |
8.0×10-4 |
5.4×10-4 |
5.4×10-4 |
|
|
n(Cr2O)/mol |
0 |
|
4.73×10-3 |
|
4.75×10-3 |
试回答下列问题:
(1)0.02 s到0.03 s之间用Cr2O表示该反应的平均反应速率为__________。
(2)下列说法正确的是( )
A.0.03 s时v正(CrO)=2v逆(Cr2O)
B.溶液pH值不变说明该反应已达平衡状态
C.溶液中c(CrO)∶c(Cr2O)=2∶1时该反应已达平衡状态
D.反应放热2.5×10-3c kJ时CrO的转化率为50%
E.升温该反应平衡常数变大
F.0.04 s时加入足量的Pb(NO3)2 可使溶液由橙色变为黄色
(3)0.03 s时溶液的pH=__________。
(4)已知酸性条件下Cr2O将Cl-氧化为Cl2,本身被还原为Cr3+为放热反应,试写出该反应的热化学方程式:____________________________________________________。
解析:0.03 s时n(Cr2O)=×(0.01 mol-5.0×10-4 mol)=4.75×10-3 mol,已经达到平衡状态。
(1)0.02 s到0.03 s之间用Cr2O表示该反应的平均反应速率为(4.75×10-3 mol-4.73×10-3 mol)÷0.05 L÷0.01 s =4×10-2 mol/(L·s)。(2)A项,0.03 s时反应达到平衡状态,v正(CrO)=2v逆(Cr2O),正确;B项,溶液pH值不变说明该反应已达平衡状态,正确;C项,溶液中c(CrO)∶c(Cr2O)=2∶1时该反应不一定达到平衡状态,错误;D项,反应放热2.5× 10-3 c kJ时,消耗5×103 mol CrO,转化率为50%,正确;E项,该反应为放热反应,升温,平衡常数变小,错误;F项,0.04 s时加入足量的Pb(NO3)2 ,c(CrO)降低溶液不会由橙色变为黄色,错误。(3)0.03 s时,=9.5×104,c(H+)=0.1 mol/L,pH=1。(4)③×16-④-⑤得Cr2O +6Cl-+14H+===3Cl2+2Cr3++7H2O ΔH=(c+b-16a)kJ/mol。
答案:(1)4×10-2 mol/(L·s) (2)ABD (3)1
(4)Cr2O +6Cl-+14H+===3Cl2+2Cr3++7H2O
ΔH=(c+b-16a)kJ/mol。
12.高炉炼铁是冶炼铁的主要方法,发生的主要反应为
Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
ΔH=a kJ/mol。
(1)已知:①Fe2O3(s)+3C(石墨,s)===2Fe(s)+3CO(g)ΔH1=+489.0 kJ/mol,
②C(石墨,s)+CO2(g)===2CO(g)
ΔH2=+172.5 kJ/mol,
则a=________。
(2)冶炼铁的反应的平衡常数表达式为K=________,温度升高后,K值______(填“增大”、“不变”或“减小”)。
(3)在T ℃时,该反应的平衡常数K=64,在2 L恒容密闭容器甲和乙中,分别按如表所示加入物质,反应经过一段时间后达到平衡。
|
|
Fe2O3 |
CO |
Fe |
CO2 |
|
甲/mol |
1.0 |
1.0 |
1.0 |
1.0 |
|
乙/mol |
1.0 |
2.0 |
1.0 |
1.0 |
①甲容器中CO的平衡转化率为________。
②下列说法正确的是________(填字母)。
a.若容器内气体密度恒定,表示反应达到平衡状态
b.甲容器中CO的平衡转化率大于乙容器中的
c.甲、乙容器中,CO的平衡浓度之比为2∶3
d.增加Fe2O3的量可以提高CO的转化率
解析:(1)根据盖斯定律,由①-②×3得Fe2O3(s)+3CO(g)
 2Fe(s)+3CO2(g) ΔH=(489.0-172.5×3)kJ/mol=-28.5 kJ/mol,故a=-28.5。(2)固体物质不能写入平衡常数表达式中,故K=。由于该反应是放热反应,升高温度平衡逆向移动,平衡常数将减小。(3)①设平衡时,反应用去x
mol CO,则平衡时CO、CO2的物质的量分别为(1-x)mol、 (1+x)mol。因化学方程式中两气体物质的化学计量数相等,所以可将物质的量直接代入平衡常数表达式中,得=64,解得x=0.6,则CO的平衡转化率为60%,平衡时CO的浓度为0.2
mol/L。②由于该反应有固体参加和生成,故只要平衡发生移动,气体的质量就会发生变化,密度也就改变,所以当气体密度恒定时,反应一定达到平衡状态,a正确;模仿上题的方法,可求得乙容器中平衡时CO的转化率为70%,浓度为0.3 mol/L,故b错误、c正确;Fe2O3是固体,增加它的量对平衡无影响,故d错误。
2Fe(s)+3CO2(g) ΔH=(489.0-172.5×3)kJ/mol=-28.5 kJ/mol,故a=-28.5。(2)固体物质不能写入平衡常数表达式中,故K=。由于该反应是放热反应,升高温度平衡逆向移动,平衡常数将减小。(3)①设平衡时,反应用去x
mol CO,则平衡时CO、CO2的物质的量分别为(1-x)mol、 (1+x)mol。因化学方程式中两气体物质的化学计量数相等,所以可将物质的量直接代入平衡常数表达式中,得=64,解得x=0.6,则CO的平衡转化率为60%,平衡时CO的浓度为0.2
mol/L。②由于该反应有固体参加和生成,故只要平衡发生移动,气体的质量就会发生变化,密度也就改变,所以当气体密度恒定时,反应一定达到平衡状态,a正确;模仿上题的方法,可求得乙容器中平衡时CO的转化率为70%,浓度为0.3 mol/L,故b错误、c正确;Fe2O3是固体,增加它的量对平衡无影响,故d错误。
答案:(1)-28.5 (2) 减小
(3)①60% ②ac
二、非选择题
11.活性炭可用于处理大气污染物NO。在1 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1℃和T2℃时,测得平衡时各物质的物质的量如表所示:
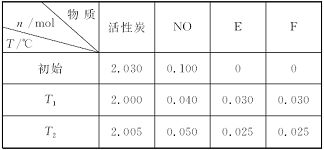
(1)请结合上表数据,写出NO与活性炭反应的化学方程式:______________________________。
(2)上述反应在 T1 ℃时的平衡常数为K1,在 T2 ℃时的 平衡常数为K2。
①计算K1=____________________。
②根据上述信息判断,T1和T2的关系是________。
a.T1>T2 b.T1<T2 c.无法比较
(3)在T1 ℃下反应达到平衡后,下列措施不能改变NO的转化率的是________(填序号)。
a.增大c(NO) b.增大压强
c.升高温度 d.移去部分F
解析:(1)由T1 ℃、T2 ℃时,活性炭、NO物质的量变化与E、F物质的量变化关系可知化学计量数之比为1∶2∶1∶1,由此写出化学方程式。(2)①T1 ℃时,NO的平衡浓度为0.04 mol/L,而CO2、N2的平衡浓度均为0.03 mol/L,则K1==(注意:活性炭为固体)。②由于无法判断反应的热效应,故无法判断T1和T2的关系。(3)该反应为气体分子数不变的反应,增大c(NO)或增大压强均不能改变NO的转化率,因此选择ab。
答案:(1)C+2NO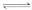 N2+CO2 (2)① ②c (3)ab
N2+CO2 (2)① ②c (3)ab
10.N2O5是一种新型硝化剂,在一定温度下可发生下列反应:2N2O5(g) 4NO2(g)+O2(g) ΔH>0。T1温度下的部分实验数据如表所示:
4NO2(g)+O2(g) ΔH>0。T1温度下的部分实验数据如表所示:
|
t/s |
0 |
500 |
1 000 |
1 500 |
|
c(N2O5)/(mol/L) |
5.00 |
3.52 |
2.50 |
2.50 |
下列说法不正确的是( )
A.500 s内N2O5分解速率为2.96×10-3 mol/(L·s)
B.T1温度下的平衡常数为K1=125,1 000 s时N2O5转化率为50%
C.其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2
D.T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3,则T1>T3
解析:选C v(N2O5)==2.96×10-3 mol/(L·s),A正确;1 000 s后N2O5的浓度不再发生变化,即达到了化学平衡,列出三种量如下:
2N2O5(g) 4NO2(g)+O2(g)
4NO2(g)+O2(g)
起始浓度(mol/L) 5.00 0 0
平衡浓度(mol/L) 2.50 5.00 1.25
则K===125,
α(N2O5)=×100%=50%,B正确;T2温度下的N2O5浓度大于 T1温度下的浓度,则改变温度使平衡逆向移动了,逆向是放热反应,则降低温度平衡向放热反应方向移动,即T2<T1,C错误;对于吸热反应来说,T越高,K越大,若K1>K3,则T1>T3,D正确。
9.(2013·杭州模拟)在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g) Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
|
温度/℃ |
25 |
80 |
230 |
|
平衡常数 |
5×104 |
2 |
1.9×10-5 |
下列说法正确的是( )
A.上述生成Ni(CO)4(g)的反应为吸热反应
B.25 ℃时反应Ni(CO)4(g) Ni(s)+4CO(g)的平衡常数为0.5
Ni(s)+4CO(g)的平衡常数为0.5
C.在80 ℃时,测得某时刻,Ni(CO)4、CO浓度均0.5 mol/L,则此时v正>v逆
D.80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol/L
解析:选D 升高温度,平衡常数减小,说明正反应是放热反应,A错误;25 ℃时,Ni(s)+4CO(g)Ni(CO)4(g)的平衡常数为5×104,则其逆反应的平衡常数为2×10-5,B错误;在80 ℃时测得某时刻Ni(CO)4、CO浓度均为0.5 mol/L,Qc=8>2,则此时v逆>v正,C错误;80 ℃达到平衡时,测得n(CO)=0.3 mol,根据平衡常数K==2,则Ni(CO)4的平衡浓度为2 mol/L,D正确。
8.(2014·盐城模拟)甲醇脱氢可制取甲醛CH3OH(g) HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图所示(已知反应在1 L的密闭容器中进行)。下列有关说法正确的是( )
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如图所示(已知反应在1 L的密闭容器中进行)。下列有关说法正确的是( )
A.脱氢反应的ΔH<0
B.600 K时,Y点甲醇的v逆<v正
C.从Y点到Z点可通过增大压强
D.在t1 K时,该反应的平衡常数为8.1
解析:选D 由曲线可知,温度升高,甲醇的平衡转化率增大,所以反应正向进行,正反应为吸热反应,ΔH<0,A错误;600 K时,Y点表示的甲醇平衡转化率偏高,反应逆向进行,v正<v逆, B错误;从Y点到Z点,若增大压强,平衡正向进行,反应吸热,温度降低,C错误;t1 K时,反应的甲醇的平衡转化率为0.9,平衡常数为K==8.1,D正确。
7.加热N2O5,依次发生的分解反应为①N2O5(g) N2O3(g)+O2(g),②N2O3(g)
N2O3(g)+O2(g),②N2O3(g)
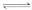 N2O(g)+O2(g)。在容积为 2 L 的密闭容器中充入8 mol N2O5,加热到t ℃,达到平衡状态后O2为9 mol,N2O3为3.4 mol,则t ℃时反应①的平衡常数为( )
N2O(g)+O2(g)。在容积为 2 L 的密闭容器中充入8 mol N2O5,加热到t ℃,达到平衡状态后O2为9 mol,N2O3为3.4 mol,则t ℃时反应①的平衡常数为( )
A.10.7 B.8.5 C.9.6 D.10.2
解析:选B N2O5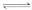 N2O3+O2
N2O3+O2
起始/mol 8 0 0
平衡/mol 8-x x x
N2O3 N2O+O2
N2O+O2
起始/mol x 0 0
平衡/mol x-y y y
,则,
所以K(①)===8.5,B正确。
6.反应Fe(s)+CO2(g) 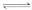 FeO(s)+CO(g),700 ℃时平衡常数为1.47,900 ℃时平衡常数为2.15。下列说法正确的是 ( )
FeO(s)+CO(g),700 ℃时平衡常数为1.47,900 ℃时平衡常数为2.15。下列说法正确的是 ( )
A.升高温度该反应的正反应速率增大,逆反应速率减小
B.该反应的化学平衡常数表达式为K=
C.该反应的正反应是吸热反应
D.增大CO2浓度,平衡常数增大
解析:选C A项,升温,正、逆反应速率均增大,错误;B项,该化学平衡常数表达式为,错误;C项,升温,平衡常数增大,表明平衡向正反应方向移动,即正反应为吸热反应,正确;D项,增大反应物浓度,平衡常数不变,错误。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com