
9.常温下,下列各组物质中,Y既能与X反应又能与Z反应的是
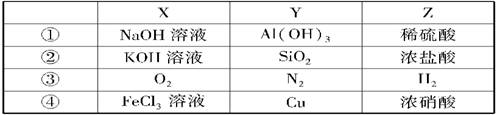
A.①③ B.①④ C.②④ D.②③
8.下列实验能达到目的的是
A.只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液
B.将NH4Cl溶液蒸干制备NH4Cl固体
C.用萃取分液的方法除去酒精中的水
D.用可见光束照射以区别溶液和胶体
7.下列关于乙醇的说法不正确的是
A.可用纤维素的水解产物制取 B.可由乙烯通过加成反应制取
C.与乙醛互为同分异构体 D.通过取代反应可制取乙酸乙酯
6.下列有关物质应用的说法正确的是
A.生石灰用作食品抗氧剂 B.盐类都可作调味品
C.铝罐可久盛食醋 D.小苏打是面包发酵粉的主要成分
7.在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:2IO+5SO+2H+===I2+5SO+H2O,生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如表所示:
|
|
实验1 |
实验2 |
实验3 |
|
0.01 mol/L KIO3酸性溶液 (含淀粉)的体积/mL |
5 |
5 |
5 |
|
0.01 mol/L Na2SO3溶液的 体积/mL |
V1 |
5 |
5 |
|
H2O的体积/mL |
35 |
40 |
V2 |
|
实验温度/℃ |
25 |
25 |
0 |
|
溶液出现蓝色所需的时间/s |
|
|
|
该实验的目的是________________________________________________;
表中V2=________mL。
解析:由实验中改变的反应条件有温度、水的体积(引起反应物浓度的变化)知,本实验探究的是反应速率与温度、浓度之间的关系,由实验2、实验3中反应条件知,二者温度不同,故其他条件应该相同,V2应该是40 mL。
答案:探究该反应的速率与温度、亚硫酸钠浓度的关系(或其他合理答案) 40
6.化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( )
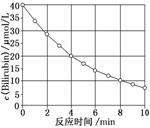
A.2.5 μmol/(L·min)和2.0 μmol/L
B.2.5 μmol/(L·min)和2.5 μmol/L
C.3.0 μmol/(L·min)和3.0 μmol/L
D.5.0 μmol/(L·min)和3.0 μmol/L
解析:选B 4~8 min间化合物Bilirubin的浓度变化为Δc=10 μmol/L,则v(Bilirubin)==2.5 μmol/(L·min);根据图示,每隔4 min化合物Bilirubin的浓度减小一半,则16 min时化合物Bilirubin的浓度为8 min时浓度的1/4,故16 min时其浓度为10 μmol/L×1/4=2.5 μmol/L,B正确。
5.草酸与高锰酸钾在酸性条件下能够发生如下反应:
MnO+H2C2O4+H+―→Mn2++CO2↑+H2O(未配平)
用4 mL 0.001 mol/L KMnO4溶液与2 mL 0.01 mol/L H2C2O4溶液研究不同条件对化学反应速率的影响。改变的条件如表所示:
|
组别 |
10%硫酸体积/mL |
温度/℃ |
其他物质 |
|
Ⅰ |
2 |
20 |
|
|
Ⅱ |
2 |
20 |
10滴饱和MnSO4溶液 |
|
Ⅲ |
2 |
30 |
|
|
Ⅳ |
1 |
20 |
1 mL蒸馏水 |
(1)该反应中氧化剂和还原剂的物质的量之比为________。
(2)如果研究催化剂对化学反应速率的影响,使用实验________和________(用Ⅰ~Ⅳ表示,下同);如果研究温度对化学反应速率的影响,使用实验________和________。
(3)对比实验Ⅰ和Ⅳ,可以研究______________________对化学反应速率的影响,实验Ⅳ中加入1 mL蒸馏水的目的是_________________________________________________。
解析:(1)根据电子守恒列式可得:n(MnO)×(7-2)=n(H2C2O4)×2×(4-3),则n(MnO)∶n(H2C2O4)=2∶5。
(2)研究某一因素对化学反应速率的影响时,要保证其他各条件完全相同。
(3)对比Ⅰ和Ⅳ,反应的温度、溶液的体积等都相同,仅有c(H+)不同,故可研究c(H+)对反应速率的影响。加1 mL水的目的是确保c(KMnO4)、c(H2C2O4)不变和总体积不变。
答案:(1)2∶5 (2)Ⅰ Ⅱ Ⅰ Ⅲ (3)c(H+)(或硫酸溶液的浓度) 确保所有实验中c(KMnO4)、c(H2C2O4)不变和总体积不变
4.
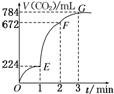
用纯净的CaCO3与100 mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积)。下列分析正确的是( )
A.OE段表示的平均速率最快
B.EF段,用盐酸表示该反应的平均反应速率为0.4 mol/(L·min)
C.OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2∶6∶7
D.F点收集到的CO2的量最多
解析:选B OE段、EF段、FG段中生成的CO2分别为0.01 mol、0.02 mol、0.005 mol,则消耗HCl的量分别为0.02 mol、0.04 mol、0.01 mol,用HCl表示的反应速率分别为0.2 mol/(L·min)、0.4 mol/(L·min)、0.1 mol/(L·min),所以EF段平均反应速率最快,G点收集到的CO2的量最多。
3.图甲、图乙分别表示反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH>0在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况,下列说法正确的是( )
CO(g)+H2O(g) ΔH>0在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况,下列说法正确的是( )
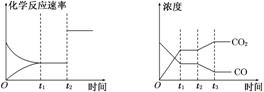
图甲 图乙
A.图甲中t2时刻发生改变的条件是增大反应物的浓度
B.图甲中t2时刻发生改变的条件可能是增大压强
C.图乙中t2时刻发生改变的条件是升高温度
D.图乙中t2时刻发生改变的条件是从体系中分离出水蒸气
解析:选B 图甲中t2时刻改变条件,正、逆反应速率同等程度的增大,且反应CO2(g)+H2(g) CO(g)+H2O(g)为反应前后气体体积不变的反应,所以改变的措施为增大压强或使用催化剂,B正确、A错误;图乙中t2时刻改变条件,CO2浓度增大,CO浓度减小,说明平衡向逆反应方向移动。升高温度,平衡正向移动,C错误;减小H2O(g)浓度,平衡向正反应方向移动,则CO2浓度减小,D错误。
CO(g)+H2O(g)为反应前后气体体积不变的反应,所以改变的措施为增大压强或使用催化剂,B正确、A错误;图乙中t2时刻改变条件,CO2浓度增大,CO浓度减小,说明平衡向逆反应方向移动。升高温度,平衡正向移动,C错误;减小H2O(g)浓度,平衡向正反应方向移动,则CO2浓度减小,D错误。
2.实验测得某反应在不同pH下产物A的浓度随时间变化的关系如图(其他条件相同)。则下列有关说法正确的是( )
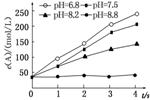
A.若增大压强,该反应的反应速率一定增大
B.pH=6.8时,随着反应的进行反应速率逐渐增大
C.一定pH范围内,溶液中H+浓度越小,反应速率越快
D.可采用调节pH的方法使反应停止
解析:选D 不知反应有没有气体参加,A错误;图像中表示反应速率的是曲线的斜率,B错误;pH越小,H+浓度越大,反应速率越快,C错误;pH=8.8时,反应速率接近于0,D正确。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com