
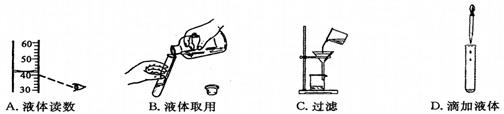
2.下列操作正确的是
一、选择题:
1.日常生活中的下列变化,属于物理变化的是( ▲ )
A、木柴燃烧 B、冰雪融化 C、白磷自燃 D、食物变质
20.(12分)测定硫酸铝晶体样品中Al2(SO4)3·18H2O(M=666g/mol)质量分数的实验步骤为(物质EDTA分别能与Al3+或Pb2+以物质的量之比1︰1进行反应):
步骤1:准确称取硫酸铝晶体样品m g,溶于水配成25 mL溶液。
步骤2:加入c1 mo1·L-1EDTA溶液V1mL(过量),煮沸、冷却,稀释至100 mL。
步骤3:取25. 00mL上述稀释液,测定得知:,当加入c2 mol·L-1Pb(NO3)2溶液V2mL 恰好与过量的EDTA溶液反应。
⑴步骤2中“稀释至100 mL”时,需要用到的玻璃仪器有烧杯、玻璃棒、量筒、
、 。
⑵请根据上述数据计算该样品中Al2(SO4)3·18H2O的质量分数。(用含字母的代数式表示)。
⑶若将步骤1所得的溶液改为滴加4mol/L NaOH溶液(杂质不参与反应),当滴加到10mL时,溶液又恰好变澄清,求步骤1溶液中硫酸铝的物质的量浓度(用具体数值表示)。
19.(10分)实验室常用二氧化锰和浓盐酸反应制取氯气:MnO2+4HCl(浓) MnCl2
+ Cl2↑+ 2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
MnCl2
+ Cl2↑+ 2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
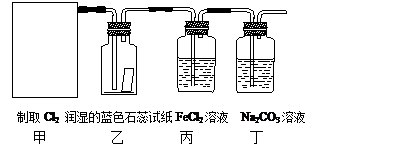
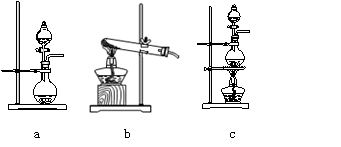
⑴在该实验中,甲部分的装置是 (填写字母)。
⑵乙装置中可观察到的颜色变化为: 。
⑶丙装置中FeCl2溶液与Cl2反应的离子方程式是 。
⑷丁装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸,则丁中发生反应的化学方程式是 。
⑸该实验存在明显的缺陷,改进的方法是 。
18.(12分)在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
I:向废液中投入过量铁屑,充分反应后分离出固体和滤液:
II:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
试 回答下列问题:
⑴FeCl3蚀刻铜箔反应生成FeCl2和CuCl2的离子方程式为 ;
证明蚀刻后的混合物溶液仍存在Fe3+的操作是:
。
⑵过程I加入铁屑的主要作用是_______ ;从固体中分离出铜需采用的方法是_________ 。
⑶过程II中发生主要反应的化学方程式为:_____ ,
。
17.(11分)直接排放含二氧化硫、氮氧化物均会危害环境,必须对它们进行处理。
⑴利用钠碱循环法可脱除烟气中的SO2。
①用化学方程式表示SO2形成硫酸型酸雨的反应:
。
②在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反
应的离子方程式是_________ 。
⑵处理氮氧化物的方法很多,以下列举几种常见方法。
①用过量NaOH溶液吸收NO2气体。所得溶液中除含有NaOH和NaNO2,还含有
。
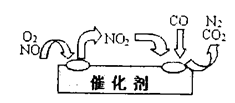
②为避免污染,常给汽车安装尾气净化装置。净化装置里装有催化剂,气体在催化剂表面吸附与解吸作用的机理如下图所示。写出净化过程中的总化学反应方程式:
。
③用氨气可以将其转化为无害气体,发生的 反应为:6NOx+4xNH3=(3+2x)N2+6xH2O。某工厂排出的尾气中NOx的含量为0.56%(体积分数), 若处理1×104L(标准状况)该尾气需42.5gNH3,则x= 。
16.(10分)下表是元素周期表的一部分,回答下列有关问题:
|
族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
2 |
|
|
|
|
① |
|
② |
|
|
3 |
③ |
④ |
⑤ |
|
|
⑥ |
⑦ |
|
|
4 |
⑧ |
⑨ |
|
|
|
|
⑩ |
|
⑴在这些元素中,某元素的氧化物既可作漂白剂又是空气质量的监测对象,该元素是 (填写序号)。
⑵在这些元素的最高价氧化物对应水化物中,酸性最强的是 (填化学式),呈两性的氢氧化物是 (填化学式);写出两者反应的离子方程式 。
⑶请写出工业上①的氢化物发生催化氧化的化学方程式_________________ 。
⑷在③与④中,化学性质较活泼的是 (填元素符号),证明该结论的化学实验是 。
15.向27.2g Cu和Cu2O(物质的量之比为2︰1)的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2 。在所得溶液中加入1.0 mol/L的NaOH溶液1.0L,此时溶液呈中性,金属离子恰好完全沉淀。下列有关说法错误的是
A.混合物中Cu的物质的量为0.2 mol
B.产生的NO在标准状况下的体积为4.48L
C.硝酸的物质的量浓度为2.6mol/L
D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
非选择题(55分)
14.右图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是

A.原子半径:R>Y>X
B.气态氢化物的稳定性:R>W
C.WX3和水反应形成的化合物具有挥发性
D.Z能和Y的最高价氧化物对应的水化物反应
13.下列离子方程式正确的是
A.氢氧化钡溶液与硫酸溶液反应:Ba2++SO42-=BaSO4↓
B.向Ca(ClO)2溶液中通入过量二氧化碳:ClO- + H2O + CO2 = HClO + CO32-
C.向氯化铝溶液中通入过量氨气:Al3++4OH-=AlO2-+2H2O
D.过氧化钠与冷水反应:2Na2O2 + 2H2O = 4Na+ + 4OH- + O2↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com