
30.(4分)将含有0.4molCuSO4和0.4molNaCl的水溶液1L,用惰性电极电解一段时间,经称量阴极增重19.2g。求:
(1)阳极上放出的氯气标况下体积为 ▲ L。 (不考虑气体在水中的溶解)
(2)电解后溶液中H+的浓度为 ▲ mol·L-1。(电解过程中溶液体积变化忽略不计)
3.6 g H2O和1.4 gN2.据此可知偏二甲肼由 ▲ 种元素组成,其中碳元素的质量分数为 ▲ .偏二甲肼的相对分子质量为60,其化学式为 ▲ 。
四、计算题
29.(6分)朝鲜“光明星3号”卫星发射火箭与我国长征号火箭使用的液体推进剂,均为偏二甲肼与四氧化二氮的混合物。3.0 g偏二甲肼在O2中充分燃烧后可生成4.4g CO2、
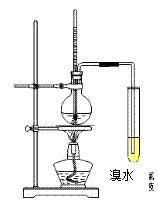
28.(共7分)实验室以浓硫酸和酒精为原料制取乙烯并进行乙烯性质实验的装置如图所示。
(1)按加入顺序写出需加入烧瓶中的物质的名称____▲_____。
(2)反应过程中发现烧瓶内液体变黑,其可能原因是 ▲ 。
(3)推测烧瓶中的气体中含的有机物除乙烯、乙醇蒸气外还可能有 ▲ 。
(4)溴水褪色后,测试发现水溶液酸性明显增大,用化学方程式表示水溶液酸性增大的原因_________▲_______。
(5)现代化工工业中大量获得乙烯的途径是________▲______(写出原料和加工名称)。
三、实验题
27.(7分)某同学进行实验探究时,需用到1.0 mol·L-1Ba(OH)2溶液,但在实验室只找到在空气中暴露已久的Ba(OH)2·8H2O(化学式量:315)试剂。在室温下配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物。
为探究原因,该同学查得Ba(OH)2·8H2O 部分溶解度数据,见下表:
|
温度 |
10℃ |
20℃ |
30℃ |
|
溶解度(g/100g H2O) |
2.5 |
3.9 |
5.6 |
(1)若该同学设计了如下实验方案,进行试剂的成分检验。请将下表中预期现象和结论填写完整。(室温时BaCO3饱和溶液的pH=9.6)
|
实验步骤 |
预期现象和结论 |
|
步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀。 |
|
 步骤2:取适量滤液于试管中,滴加稀硫酸。 步骤2:取适量滤液于试管中,滴加稀硫酸。 |
①若出现
▲ 现象;则说明原试剂中有 ▲ 。 |
|
步骤3:取适量步骤1中的沉淀于试管中,滴加盐酸,连接带塞导气管将产生的气体导入澄清石灰水。 |
②若出现
▲ 现象;则说明试剂中含有
▲ 。 |
|
步骤4:取步骤1中的滤液于烧杯中, 用pH计测定其pH。 |
③若pH_ ▲ ,说明该试剂中
▲ 。 |
(2)将试剂初步提纯后,准确测定其中Ba(OH)2·8H2O的含量。
实验如下:①配制250 mL 约0.1mol·L-1Ba(OH)2溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水,搅拌,将溶液转入 ▲ 中,洗涤,定容,摇匀。
②滴定:准确量取25.00mL所配制Ba(OH)2溶液于锥形瓶中,滴加指示剂,将 ▲ (选填“0.020”、“0.05”、“0.1980”或“1.5”)mol·L- 1盐酸装入50mL酸式滴定管,滴定至终点,记录数据。重复滴定2次。
1盐酸装入50mL酸式滴定管,滴定至终点,记录数据。重复滴定2次。
 (3)室温下, ▲
(选填“能”或“不能”) 配制1.0 mol·L-1Ba(OH)2溶液,用估算后的数据说明理由____________▲______________。
(3)室温下, ▲
(选填“能”或“不能”) 配制1.0 mol·L-1Ba(OH)2溶液,用估算后的数据说明理由____________▲______________。
26.(6分)保鲜膜按材质分为聚乙烯(PE)、聚氯乙烯(PVC)和聚偏二氯乙烯(PVDC)。其中PE和PVDC是安全的,PVC对人体有潜在危害。工业上用乙烯和氯气为主要原料来合成上述三种物质。

完成下列填空:
(1)高聚物PE的链节为___________;A物质的名称是_____________。
(2)反应①和②均需控制适当的反应条件,反应①的反应类型是_______________;D的同分异构体的结构简式为_______________。
(3)写出反应②的化学方程式______________________________________________。
25.(6分)1 mol分子组成为C3H8O2的液体有机物A,与足量的金属钠作用,可生成22.4 L氢气(标准状况),则:
(1)A分子中含有的官能团名称为____▲_____,A中的官能团均在碳链的末端,A的键线式可表达为_______▲______。
(2)A与足量氧化铜共热,可生成B,B的结构简式为_______▲_______。
(3)B在催化剂作用下与氧气反应生成C。A与C在一定条件反应生成聚酯类高分子化合物D,D的结构简式为____________▲___________。
24.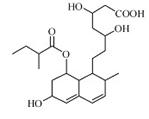 (6分)普伐他汀是一种调节血脂的药物,其结构简式如图所示。
(6分)普伐他汀是一种调节血脂的药物,其结构简式如图所示。
(1)该有机物的分子中含有 ▲ 个碳原子。
(2)该有机物不能发生 ▲ 反应。(请填序号)
a.取代反应 b.消去反应 c.加成反应 d. 水解反应 e.与新制氢氧化铜悬浊液的反应 f. 与三氯化铁溶液反应呈紫色的显色反应
(3)1 mol该有机物与足量的氢氧化钠溶液充分反应,最多消耗氢氧化钠 ▲ mol。
23.(6分)在体积为1L的两个恒容密闭容器中,分别充入1molCO和1molH2O(g)的混合气体,进行如下化学反应:CO(g)+H2O(g)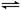 CO2(g)+H2(g),反应物CO的物质的量在不同温度时物质的量随时间的变化如下表所示,回答下列问题:
CO2(g)+H2(g),反应物CO的物质的量在不同温度时物质的量随时间的变化如下表所示,回答下列问题:
|
|
0min |
10min |
20min |
30min |
40min |
50min |
|
830℃ |
1mol |
0.8mol |
0.65mol |
0.55mol |
0.5mol |
0.5mol |
|
1100℃ |
1mol |
0.75mol |
0.6mol |
0.6mol |
0.6mol |
0.6mol |
(1)1100℃时,前10min该反应的化学反应速率v(CO2)= ▲ 。
(2)计算1100℃时该反应的化学平衡常数K=_▲__。
(3)能判断该反应是否达到化学平衡状态的依据是_______▲________。
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O) (d)c(CO2)=c(CO)
(4)1100℃时达到平衡后,若向容器中再充入2molCO和2molH2O(g),平衡___▲__移动(选填“向右”或“向左”或“不”),再达到平衡时,H2百分含量__▲__(选填“增大”或“减小”或“不变”)。
22.(6分)电镀废水有毒成分很多,其中主要有毒性很大的含铬(Cr)废水与含氰(CN-)废水。
(1)含铬废水中存在如下平衡2CrO42-+2H+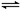 Cr2O72-+H2O
,该废水处理工艺中往往先加以酸化,使得(Cr)在溶液中的主要存在形式是 ▲ ;酸化后的溶液加入硫酸亚铁,使(Cr)转化为毒性较低的Cr3+,写出该反应的离子反应方程式 ▲ 。
Cr2O72-+H2O
,该废水处理工艺中往往先加以酸化,使得(Cr)在溶液中的主要存在形式是 ▲ ;酸化后的溶液加入硫酸亚铁,使(Cr)转化为毒性较低的Cr3+,写出该反应的离子反应方程式 ▲ 。
(2)含氰废水在酸性条件下用强氧化剂(NaClO)处理称为“破氰”,破氰后的产物均无毒,该氧化还原反应中的还原产物最可能是 ▲ ;氧化产物最可能是 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com