
8.下列各项操作中,发生“先产生沉淀后沉淀又溶解”现象的是
A.向Fe(OH)3胶体中逐滴滴加入过量的稀硫酸 B.向饱和碳酸钠溶液中通入过量的CO2
C.向氨水中逐滴加入AgNO3溶液至过量 D.向硅酸钠溶液中逐滴加入过量的盐酸
 7.碘在水中溶解度很小,但易溶于KI溶液,因为发生反应:I2(aq)+I―(aq)=I3―。已知在不同温度下该反应的平衡常数如右图:
7.碘在水中溶解度很小,但易溶于KI溶液,因为发生反应:I2(aq)+I―(aq)=I3―。已知在不同温度下该反应的平衡常数如右图:
下列说法不正确的是
A.上述反应正反应为放热反应
B.实验室配制碘水,为增大碘的溶解度可加入少量的KI
C.用该反应原理可除去硫粉中少量的碘单质
D.上述体系中加入苯,平衡不移动
6.常温下单质硫主要以S8形式存在。加热时,S8会转化为S6、S4、S2等。当温度达到
A.S8转化为S6、S4、S2属于物理变化 B.不论哪种硫分子,完全燃烧时都生成SO2
C.常温条件下单质硫为原子晶体
D.把硫单质在空气中加热到
5.下列关于普通玻璃的叙述中,正确的是
A.它是人类是早使用的硅酸盐材料 B.红色玻璃中含氧化亚铜
C.它在加热熔化时有固定的熔点 D.无色玻璃是纯净物
4.下列关于有机物的性质或应用说法不正确的是
A.用饱和的Na2SO4溶液使蛋清液发生盐析,进而分离、提纯蛋白质
B.淀粉和纤维素的组成都可用(C6H10O5)n表示,它们都可转化为乙醇
C.石油裂解可以得到甲烷、乙烯和丙烯等低碳有机物
D.食用植物油在烧碱溶液水解主要产物是高级饱和脂肪酸钠和甘油
3.镁-H2O2酸性燃料电池采用海水作电解质(加入一定量的酸),下列结论不正确的是
A.电池总反应为:Mg+H2O2=Mg(OH)2
B.正极发生的电极反应为:H2O2+2H++2e-=2H2O
C.工作时,正极周围海水的pH增大
D.电池工作时,溶液中的H+向正极移动
D.称量2.9gNa2CO3?10H2O晶体溶于100 mL 水配制取0.10 mol?L-1 的纯碱溶液
2.下列实验能达到预期目的的是
A.加NaOH溶液后进行分液分离乙醇和苯酚
B.MgCl2、AlCl3溶液中分别通入NH3,比较镁、铝的金属性强弱
C.测定Na2CO3、Na2SO4两溶液的pH,比较碳、硫的非金属性强弱
1.化学与生活密切相关,下列有关做法正确的是
A.为增加明矾净水效果,可同时加入氢氧化钡溶液
B.为防止铁制品生锈,可在铁制品的外层涂油漆或局部镀铜
C.为增加Na2CO3的除油污效果,可使用热水洗涤
D.为防止植物油脂氧化,可将植物油脂露置于日光下
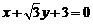 相切,求椭圆C的方程.
相切,求椭圆C的方程.
广东省梅县华侨中学2008届高考最后冲刺测试题
(文科数学)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com