
1. (2013·惠州调研改编)利用海水资源进行化工生产的部分工艺流程如下图:
海水 粗盐
粗盐

(1) 流程Ⅰ中,欲除去粗盐中含有的Ca2+、Mg2+、S 等离子,需将粗盐溶解后,按序加入药品进行沉淀、过滤等。加入药品和操作的顺序可以是 (填字母)。
等离子,需将粗盐溶解后,按序加入药品进行沉淀、过滤等。加入药品和操作的顺序可以是 (填字母)。

a. Na2CO3、NaOH、BaCl2、过滤、盐酸
b. NaOH、BaCl2、Na2CO3、过滤、盐酸
c. NaOH、Na2CO3、BaCl2、过滤、盐酸
d. BaCl2、Na2CO3、NaOH、过滤、盐酸
(2) 流程Ⅱ中,电解饱和NaCl溶液的离子方程式为 。通电开始后,阳极区产生的气体是 ,阴极附近溶液pH会 (填“增大”、“减小”或“不变”)。
(3) 流程Ⅲ中,通过反应得到NaHCO3晶体。右图为NaCl、NH4Cl、NaHCO3、NH4HCO3的溶解度曲线,其中能表示NaHCO3溶解度曲线的是 ,反应的化学方程式是 。
(4) 流程Ⅳ中,所得纯碱常含有少量可溶性杂质,提纯它的过程如下:将碳酸钠样品加适量水溶解、 、 、过滤、洗涤23次,得到纯净的Na2CO3·10H2O,Na2CO3·10H2O脱水得到无水碳酸钠。
3. 课本上的重要物质制备的流程图
(1)侯氏制碱工艺
 —
—
(2) 从海水中提取碘
海带
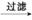 滤液
滤液

 I2
I2
(3) 工业合成硫酸
FeS2 SO2
SO2 SO3
SO3 发烟硫酸
发烟硫酸
(4) 工业合成硝酸
NH3 NO
NO NO2
NO2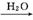 HNO3
HNO3
(5) 从海水中提取镁
贝壳(CaCO3)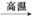 CaO
CaO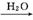

 Mg(OH)2
Mg(OH)2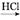 MgCl2
MgCl2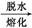
 Mg
Mg
(6) 从铝土矿中提取铝
铝土矿(Al2O3) NaAlO2
NaAlO2 Al(OH)3
Al(OH)3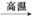 Al2O3
Al2O3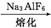
 Al
Al

课堂评价
2. 重要无机物的性质
|
元素 |
物质 |
用途或应用 |
|
元素 |
物质 |
用途或应用 |
|
|
Na |
Na2O2 |
氧化剂,漂白剂,杀菌消毒,供氧剂 |
|
Fe |
Fe |
各种铁合金 |
|
|
Na2CO3 |
食用碱,生产洗涤剂,玻璃 |
Fe2O3 |
红色涂料、油漆,炼铁 |
|
|||
|
NaHCO3 |
食用碱,治疗胃酸过多 |
FeCl3 |
刻蚀铜质电路板 |
|
|||
|
Al |
Al |
铝合金 |
|
卤素 |
Cl2 |
自来水消毒,生产漂白剂、消毒剂,冶炼金属 |
|
|
Al2O3 |
制耐高温材料,冶炼金属铝 |
ClO2 |
自来水消毒 |
|
|||
|
Al(OH)3 |
治疗胃酸过多,胶体可作净水剂、阻燃剂 |
HF |
雕刻玻璃 |
|
|||
|
Si |
Si |
光电池,半导体 |
|
S |
S |
生产硫酸 |
|
|
SiO2 |
光导纤维 |
||||||
|
SO2 |
生产硫酸,漂白纸浆 |
||||||
|
H2SiO3 |
硅胶干燥剂,催化剂载体 |
||||||
|
N |
NH3 |
生产氮肥、硝酸,作制冷剂 |
|||||
|
Na2SiO3 |
木材防火剂 |
||||||
|
铵盐 |
实验室制NH3、氮肥 |
||||||
|
SiC |
制砂轮、砂纸 |
|
对于试题中出现的其他物质的性质与用途的关系,在复习中要勤做笔记,理解物质的这种用途是基于它的哪种性质,最终形成知识和能力,实现考点的突破。
1. 元素及其化合物的转化关系
在解答物质制备与化学工艺流程题时,面对众多的化学反应,首先需要系统的复习和掌握元素及其化合物的转化关系。我们可通过具体直观的网络图有选择性地进行归纳。
(请同学们试着写出下列网络图中物质间转化的化学方程式或离子方程式)
(1) 钠及其化合物间的转化关系

(2) 铝及其化合物间的转化关系

(3) 铁及其化合物间的转化关系

(4) 碳、硅及其化合物间的转化关系
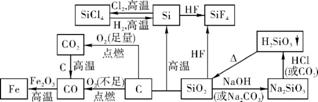
(5) 氯气及其化合物间的转化关系

(6) 硫及其化合物间的转化关系

(7) 氮气及其化合物间的转化关系

2. (2013·江门一模)化工原料红矾钠(重铬酸钠:Na2Cr2O7·2H2O)主要是以铬铁矿(主要成分为FeO·Cr2O3,还含有Al2O3、SiO2等杂质)为主要原料生产,其主要工艺流程如下:
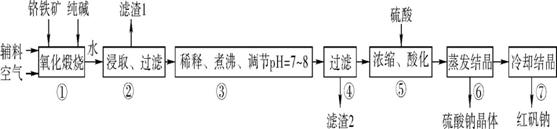
步骤①中主要反应的化学方程式如下:
4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
(1) ①中反应是在回转窑中进行的,反应时需不断搅拌,其作用是 。
(2) 杂质Al2O3、SiO2在①中转化的化学反应方程式为 、 。
(3) 用化学平衡移动原理说明③中煮沸的作用是 (用离子方程式结合文字说明),若调节pH过低产生的影响是 。
(4) ⑤中酸化是使Cr 转化为Cr2
转化为Cr2 ,写出该反应的离子方程式: 。
,写出该反应的离子方程式: 。

(5) 工业上还可用电解法制备重铬酸钠,其装置示意图如右。
阴极的电极反应式为 ;
阳极的电极反应式为 。

|
1. 原料浸出可加入哪些类别的物质目的是什么 |
|
2. 试归纳在化工流程题常出现的物质制备原理有哪些,其中常用到的物质分离提纯的方法有哪些 |
|
|
[基础回顾]
1. (2013·广州一模)某科研小组以难溶性钾长石(K2O·Al2O3·6SiO2)为原料,提取Al2O3、K2CO3等物质,工艺流程如下:

(1) 煅烧过程中有如下反应发生。
①钾长石中的硅元素在CaCO3作用下转化为CaSiO3,写出SiO2转化为CaSiO3的化学方程式: 。
②钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的NaAlO2和KAlO2,写出Al2O3转化为NaAlO2的化学方程式: 。
(2) 已知NaAlO2和KAlO2易发生如下水解反应:Al +
2H2O
+
2H2O Al(OH)3
+ OH-。
Al(OH)3
+ OH-。
“浸取”时应保持溶液呈 (填“酸”或“碱”)性。 “浸取”时不断搅拌的目的是 。
(3) “转化”时加入NaOH的主要作用是 (用离子方程式表示)。
(4) 上述工艺中可以循环利用的主要物质是 、 和水。
4. (2010·广东高考第32题)碳酸锂广泛应用于陶瓷和医药等领域。以β 锂辉石(主要成分为Li2O·Al2O3·4SiO2)为原料制备Li2CO3的工艺流程如下:
锂辉石(主要成分为Li2O·Al2O3·4SiO2)为原料制备Li2CO3的工艺流程如下:

已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4;Li2SO4、LiOH和Li2CO3在303 K下的溶解度分别为34.2g、12.7g和1.3g。
(1) 步骤Ⅰ前,β 锂辉石要粉碎成细颗粒的目的是 。
锂辉石要粉碎成细颗粒的目的是 。
(2) 步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li+、S ,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入 (填“石灰石”、“氯化钙”或“稀硫酸”)以调节溶液的pH至6.06.5,沉淀部分杂质离子,然后分离得到浸出液。
,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入 (填“石灰石”、“氯化钙”或“稀硫酸”)以调节溶液的pH至6.06.5,沉淀部分杂质离子,然后分离得到浸出液。
(3) 步骤Ⅱ中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去的杂质金属离子有 。
(4) 步骤Ⅲ中,生成沉淀的离子方程式为 。
(5) 从母液中可回收的主要物质是 。

3. (2011·广东高考第32题)由熔盐电解法获得的粗铝含有一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝。工艺流程如下:
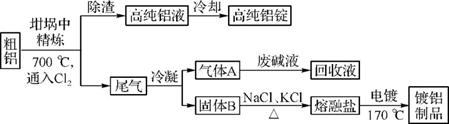
注:NaCl熔点为801℃;AlCl3在181℃升华。
(1) 精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,相关的化学方程式为 和 。
(2) 将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮除去。气泡的主要成分除Cl2外还含有 ;固态杂质黏附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在 。
(3) 在用废碱液处理A的过程中,所发生反应的离子方程式为 。
(4) 镀铝电解池中,金属铝为 极。熔融盐电镀液中铝元素和氯元素主要以AlC 和Al2C
和Al2C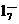 形式存在,铝电极的主要电极反应式为 。
形式存在,铝电极的主要电极反应式为 。
(5) 钢材镀铝后,表面形成的致密氧化铝膜能防止钢材腐蚀,其原因是
。
2. (2012·广东高考第32题节选)难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡:K2SO4·MgSO4·2CaSO4·2H2O(s) 2Ca2++2K++Mg2++4S
2Ca2++2K++Mg2++4S +2H2O。为能充分利用钾资源,用饱和 Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
+2H2O。为能充分利用钾资源,用饱和 Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:


(1) 滤渣的主要成分有 和 以及未溶杂卤石。
(2) 用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因: 。
(3) “除杂”环节中,先加入 溶液,经搅拌等操作后,过滤,再加入 溶液调节滤液pH至中性。
(4) 不同温度下,K+的浸出浓度与溶浸时间的关系如上图,由图可得:随着温度的升高,① ;② 。
1. (2013·广东高考第32题)银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:

注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃。
(1) 电解精炼银时,阴极反应式为 ;滤渣A与稀硝酸反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为 。
(2) 固体混合物B的组成为 ;在生成固体B的过程中,需要控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为 。
(3) 完成煅烧过程中一个反应的化学方程式: CuO + Al2O3 CuAlO2+ ↑。
CuAlO2+ ↑。
(4) 若银铜合金中铜的质量分数为63.5%,理论上5.0kg废料中的铜可完全转化为 molCuAlO2,至少需要1.0mol·L-1Al2(SO4)3溶液 L。
(5) CuSO4溶液也可用于制备胆矾,其基本操作为 、过滤、洗涤和干燥。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com