
1. (1) bd
(2) 2Cl-+2H2O 2OH-+H2↑+Cl2↑ Cl2(或氯气) 增大
2OH-+H2↑+Cl2↑ Cl2(或氯气) 增大
(3) d NaCl+CO2+NH3+H2O NaHCO3↓+NH4Cl
NaHCO3↓+NH4Cl
(4) 蒸发浓缩 冷却结晶
2. (1) 增大反应物的接触面积,加快反应速率
(2) Al2O3+Na2CO3 2NaAlO2+CO2↑
2NaAlO2+CO2↑
SiO2+Na2CO3 Na2SiO3+CO2↑
Na2SiO3+CO2↑
(3) 水解吸热,煮沸促进水解平衡Al +2H2O
+2H2O Al(OH)3+OH-、Si
Al(OH)3+OH-、Si +H2O
+H2O HSi
HSi +OH-向右移动,生成氢氧化铝、硅酸沉淀 H+将水解生成的氢氧化铝沉淀溶解,杂质Al3+与Na2CrO4难以分离
+OH-向右移动,生成氢氧化铝、硅酸沉淀 H+将水解生成的氢氧化铝沉淀溶解,杂质Al3+与Na2CrO4难以分离
(4) 2Cr +2H+
+2H+ Cr2
Cr2 +H2O
+H2O
(5) 4H2O+4e- 4OH-+2H2↑
4OH-+2H2↑
4OH--4e- O2↑+2H2O
O2↑+2H2O
[典题演示]
变式训练1 (1) V2O5 (2) VOSO4
(3) N +V
+V
 NH4VO3↓ 4 80 (4)
2 2
NH4VO3↓ 4 80 (4)
2 2
(5) V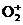 +2H++e-
+2H++e- VO2++H2O
VO2++H2O
变式训练2 (1) bc
(2) Mn2++ClO-+H2O MnO2↓+2H++Cl-
MnO2↓+2H++Cl-
促进Al3+、Fe3+水解
(3) Fe(OH)3、Al(OH)3
(4) CaSO4·2H2O(或CaSO4) 防止MgSO4在温度低时结晶析出 漏斗、玻璃棒 降低CaSO4·2H2O的溶解度(或减少CaSO4·2H2O的溶解)
(5) Mg2+、Na+ 取滤液12 mL于试管中,加几滴盐酸和几滴BaCl2溶液,若有白色沉淀生成,说明有S
变式训练3 (1) ABC
(2) 28 H+ 2 15 Mn2+ 14 H2O 4
(3) 使残余Fe2+转化为Fe3+ 3.75.2
(4) 1.46×10-6
(5) pH等于7.0时反应速率最快,且MnCO3的产率最高
(6) (NH4)2SO4
[课堂评价]
1. (1) ①CaCO3+SiO2 CaSiO3+CO2↑
CaSiO3+CO2↑
②Na2CO3+Al2O3 2NaAlO2+CO2↑
2NaAlO2+CO2↑
(2) 碱 提高浸取速率
(3) HC +OH-
+OH- H2O+C
H2O+C
(4) Na2CO3 CO2
4. (1) 增大固液接触面积,加快浸出反应速率,提高浸出率 (2) 石灰石 (3) Fe2+、Mg2+、Ca2+
(4) 2Li++C
 Li2CO3↓ (5)
Na2SO4
Li2CO3↓ (5)
Na2SO4
[高考前沿]
3. (1) 2Al+Fe2O3 2Fe+Al2O3
2Fe+Al2O3
4Al+3SiO2 3Si+2Al2O3
3Si+2Al2O3
(2) HCl和AlCl3 NaCl
(3) Cl2+2OH- Cl-+ClO-+H2O、H++OH-
Cl-+ClO-+H2O、H++OH- H2O
H2O
(4) 阳 Al+7AlC -3e-
-3e- 4Al2C
4Al2C
(5) 氧化铝膜能阻止内部的金属继续被氧化,起到防腐蚀保护作用
2. (1) CaSO4 Mg(OH)2
(2) 氢氧根与镁离子结合生成Mg(OH)2,使平衡向右移动,K+变多
(3) K2CO3 H2SO4
(4) ①平衡时K+的浸出浓度增大 ②反应的速率加快,平衡时溶浸时间缩短
1. (1) Ag++e- Ag 2NO+O2
Ag 2NO+O2 2NO2
2NO2
(2) CuO、Al(OH)3 Al(OH)3+OH- Al
Al +2H2O
+2H2O
(3) 4 2 4 O2
(4) 50.0 25.0
(5) 蒸发浓缩、冷却结晶
2. 制备原理有:氧化还原法、复分解反应或饱和溶液与晶体析出、水解反应、沉淀溶解平衡、热分解法、电解法等。常用到的物质分离提纯的方法有:过滤、趁热过滤、蒸发浓缩、冷却结晶、重结晶、萃取等。

趁热打铁,事半功倍。请同学们及时完成《配套检测与评估》中的练习第179-181页。
第三篇 化学工艺流程
专题九 物质的制备与化学工艺流程综合题型研究
[高考回眸]
1. 酸、碱、水、有机溶剂如乙醇等。目的是使原料形成离子与不溶物分离。
2. (2013·梅州一模改编)工业上用重晶石(BaSO4)制备BaCO3的常用方法主要有高温煅烧还原法、沉淀转化法等。高温煅烧还原法的工艺流程可简单的表示如下:
重晶石矿粉 BaS等
BaS等 溶液
溶液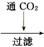 BaCO3
BaCO3
(1) 若“煅烧”时产生一种有毒的还原性气体,则反应的化学方程式为 。
(2) 在第一次过滤后洗涤,检验是否洗涤干净的试剂最好是 。
(3) 沉淀转化法制备BaCO3可用饱和Na2CO3溶液将BaSO4转化为BaCO3 :
BaSO4(s)+C (aq)
(aq) BaCO3(s)+S
BaCO3(s)+S (aq)
(aq)
①在实验室将少量BaSO4固体全部转化为BaCO3的实验操作方法与步骤为 。
②与高温煅烧还原法相比,沉淀转化法的优点主要有 。
③已知Ksp(BaCO3)=2.40×10-9,Ksp(BaSO4)=1.20×10-10。现欲用沉淀转化法将BaSO4转化为BaCO3,该反应的平衡常数为 。如用1.00L0.210mol·L-1 Na2CO3溶液处理,试计算BaSO4被转化的质量(写出计算过程,结果保留3位有效数字)。
[问题思考]提示
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com