
2. (2013·汕头一模)为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究。
(1) ①把含有较高浓度CO2的空气通入饱和K2CO3溶液。②在①的吸收液中通高温水蒸气得到高浓度的CO2气体。写出②中反应的化学方程式: 。
(2) 如将CO2与H2 以1∶3的体积比混合。
①适当条件下合成某烃和水,该烃是 (填字母)。
A. 烷烃 B. 烯烃
C. 炔烃 D. 苯的同系物
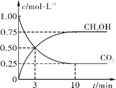
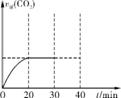
②适当条件下合成燃料甲醇和水。在体积为2L的密闭容器中,充入2molCO2和6molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0kJ·mol-1。
CH3OH(g)+H2O(g) ΔH=-49.0kJ·mol-1。
测得CO2(g)和CH3OH(g)的浓度随时间变化如上图所示。
从反应开始到平衡,v(H2)= ;氢气的转化率为 ;能使平衡体系中n(CH3OH)增大的措施有 。
(3) 如将CO2与H2以1∶4的体积比混合,在适当的条件下可制得CH4。已知:
CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH1=—890.3kJ·mol-1
CO2(g)+2H2O(l) ΔH1=—890.3kJ·mol-1
H2(g)+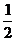 O2(g)
O2(g) H2O(l)
ΔH2=-285.8kJ·mol-1
H2O(l)
ΔH2=-285.8kJ·mol-1
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是 。
(4) 某同学用沉淀法测定含有较高浓度CO2的空气中CO2的含量,经查得一些物质在20℃的数据如下表。
|
溶解度(S)/g |
溶度积(Ksp) |
||
|
Ca(OH)2 |
Ba(OH)2 |
CaCO3 |
BaCO3 |
|
0.16 |
3.89 |
2.9×10-9 |
2.6×10-9 |
注:Ksp越小,表示该物质在水溶液中越易沉淀。
吸收CO2最合适的试剂是 [填“Ca(OH)2”或“Ba(OH)2”]溶液,实验时除需要测定工业废气的体积(折算成标准状况)外,还需要测定 。
[问题思考]提示
1. (2013·广州三模)乙醇是重要的化工产品和液体燃料。乙醇在不同温度时脱水得到的产物不同。下表和下图是在常压和某催化剂存在时,用等量的乙醇在不同温度下做脱水实验获得的数据和图形,每次实验反应的时间均相同。
|
温度/℃ |
乙醇转化率/% |
有机产物含量(体积分数) |
|
|
乙烯/% |
乙醚/% |
||
|
125 |
20 |
8.7 |
90.2 |
|
150 |
68 |
16.7 |
82.2 |
|
175 |
88 |
32.3 |
66.8 |
|
200 |
90 |
86.9 |
12.1 |
(1) 已知:乙醇和乙醚(CH3CH2OCH2CH3)的沸点分别为78.4℃和34.5℃,试分析:
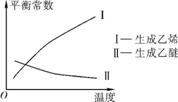
①乙醇脱水制乙烯的反应是 (填“放热”或“吸热”)反应。
②乙醇脱水制乙醚反应的平衡常数表达式为 。当乙醇的起始浓度相同时,平衡常数K越大,表明 (填字母)。
a. 乙醇的转化率越高
b. 化学反应速率越快
c. 达到平衡时乙醇的浓度越大
d. 反应进行得越完全
③根据表中数据分析,150℃时乙醇催化脱水制取乙醚的产量 (填“大于”、“小于”或“等于”)125℃时制取乙醚的产量;为了又快又多地得到产品乙醚,乙醇制乙醚合适的反应温度区域是 。
(2) 汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度的变化情况如下图。请写出提高NO转化为N2的转化率的措施: (写出一条);在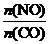 =1的条件下,应控制的最佳温度在 左右。
=1的条件下,应控制的最佳温度在 左右。

(3) 用活性炭还原法处理氮氧化物。有关反应为C(s)+2NO(g) N2(g)+CO2(g)。某研究小组向某密闭容器中加入足量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)。某研究小组向某密闭容器中加入足量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
|
浓度/mol·L-1时间/min |
NO |
N2 |
CO2 |
|
0 |
1.00 |
0 |
0 |
|
20 |
0.40 |
0.30 |
0.30 |
|
30 |
0.40 |
0.30 |
0.30 |
|
40 |
0.32 |
0.34 |
0.17 |
|
50 |
0.32 |
0.34 |
0.17 |
30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 。右图表示CO2的逆反应速率[v逆(CO2)]随反应时间的变化关系图。请在图中画出在30min后改变上述条件时,在40min时再次达到平衡的变化曲线。
2. (2013·佛山二模改编)以下是一些物质的熔、沸点数据(常压):
|
|
钾 |
钠 |
Na2CO3 |
金刚石 |
石墨 |
|
熔点/℃ |
63.65 |
97.8 |
851 |
3550 |
3850 |
|
沸点/℃ |
774 |
882.9 |
1850(分解产生CO2) |
— |
4250 |
金属钠和CO2在常压、890℃发生如下反应:
4Na(g)+3CO2(g) 2Na2CO3(l)+C(s,金刚石) ΔH=-1080.9kJ·mol-1
2Na2CO3(l)+C(s,金刚石) ΔH=-1080.9kJ·mol-1
(1) 上述反应的平衡常数表达式为 ;若4v正(Na)= 3v逆(CO2),反应是否达到平衡 (填“是”或“否”)。
(2) 若反应在10L密闭容器、常压下进行,温度由890℃升高到1860℃,若反应时间为10min, 金属钠的物质的量减少了0.2mol,则10min内CO2的平均反应速率为 。
(3) 高压下有利于金刚石的制备,理由是 。

|
1. 请谈谈化学平衡常数与温度的关系。 |
|
2. 影响化学反应速率的因素有哪些如何解答有关化学平衡的图像题 |
|
|

课堂评价
1.(2013·汕头二模)氢是一种理想的绿色清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。 利用FeO/Fe3O4循环制氢,已知:
H2O(g)+3FeO(s) Fe3O4(s)+H2(g) ΔH=akJ·mol-1 (Ⅰ)
Fe3O4(s)+H2(g) ΔH=akJ·mol-1 (Ⅰ)
2Fe3O4(s) 6FeO(s)+O2(g) ΔH=bkJ·mol-1 (Ⅱ)
6FeO(s)+O2(g) ΔH=bkJ·mol-1 (Ⅱ)
下列坐标图分别表示FeO的转化率(图1 )和一定温度下,H2的生成速率[细颗粒(直径0.25mm), 粗颗粒(直径3mm)](图2)。
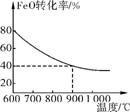
图1
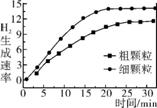
图2
(1) 反应:2H2O(g) 2H2(g)+O2(g) ΔH= (用含a、b的代数式表示)。
2H2(g)+O2(g) ΔH= (用含a、b的代数式表示)。
(2) 上述反应b>0,要使该制氢方案有实际意义,从能源利用及成本的角度考虑,实现反应Ⅱ可采用的方案是 。
(3) 900℃时,在两个体积均为2L的密闭容器中分别投入0.60molFeO和0.20molH2O(g),甲容器用细颗粒FeO、乙容器用粗颗粒FeO。
①用细颗粒FeO和粗颗粒FeO时,H2生成速率不同的原因是 。
②用细颗粒FeO时H2O(g)的转化率比用粗颗粒FeO时 H2O(g)的转化率 (填“大”、“小”或“相等”)。
③求此温度下该反应的平衡常数K(写出计算过程)。
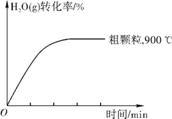
(4) 在下列坐标图中画出在1000℃、用细颗粒FeO时,H2O(g)转化率随时间变化示意图(进行相应的标注)。
4. (2010·广东高考第31题节选)硼酸(H3BO3)在食品、医药领域应用广泛。
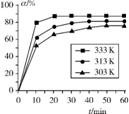
(1) 在其他条件相同时,反应H3BO3+3CH3OH B(OCH3)3+3H2O中,H3BO3的转化率(α)在不同温度下随反应时间(t)的变化如右图,由此图可得出:温度对该反应的反应速率和平衡移动的影响是 。
B(OCH3)3+3H2O中,H3BO3的转化率(α)在不同温度下随反应时间(t)的变化如右图,由此图可得出:温度对该反应的反应速率和平衡移动的影响是 。
(2) H3BO3溶液中存在如下反应:H3BO3(aq)+H2O(l) [B(OH)4]-(aq)+H+(aq)。已知0.70mol·L-1
H3BO3溶液中,上述反应于298 K达到平衡时,c平衡(H+)=2.0×10-5mol·L-1,c平衡(H3BO3)≈c起始(H3BO3),水的电离可忽略不计,求此温度下该反应的平衡常数K。(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)
[B(OH)4]-(aq)+H+(aq)。已知0.70mol·L-1
H3BO3溶液中,上述反应于298 K达到平衡时,c平衡(H+)=2.0×10-5mol·L-1,c平衡(H3BO3)≈c起始(H3BO3),水的电离可忽略不计,求此温度下该反应的平衡常数K。(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)
3. (2011·广东高考第31题)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化如右图所示。

(1) 在030 h内,CH4的平均生成速率vⅠ、vⅡ和vⅢ从大到小的顺序为 。反应开始后的12 h内,在第 种催化剂的作用下,收集的CH4最多。
(2) 将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g) CO(g)+3H2(g),该反应的ΔH=+206
kJ·mol-1。
CO(g)+3H2(g),该反应的ΔH=+206
kJ·mol-1。
①在坐标图中,画出反应过程中体系的能量变化图(进行必要的标注)。
②将等物质的量的CH4和H2O(g)充入1L恒容密闭反应器,某温度下反应达到平衡,平衡常数K=27,此时测得CO的物质的量为0.10mol,求CH4的平衡转化率。(计算结果保留两位有效数字)
2. (2012·广东高考第31题)碘在科研与生活中有重要应用。某兴趣小组用0.50mol·L-1KI、0.2%淀粉溶液、0.20mol·L-1K2S2O8、0.10mol·L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2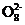 +2I-
+2I- 2S
2S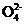 +I2(慢)
+I2(慢)
I2+2S2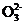
 2I-+S4
2I-+S4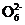 (快)
(快)
(1) 向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的 耗尽后,溶液颜色将由无色变为蓝色。为确保能观察到蓝色,S2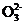 与S2
与S2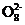 初始的物质的量需满足的关系为n(S2
初始的物质的量需满足的关系为n(S2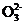 )∶n(S2
)∶n(S2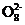 ) 。
) 。
(2) 为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
|
实验 序号 |
体积V/mL |
||||
|
K2S2O8溶液 |
水 |
KI溶液 |
Na2S2O3溶液 |
淀粉溶液 |
|
|
① |
10.0 |
0.0 |
4.0 |
4.0 |
2.0 |
|
② |
9.0 |
1.0 |
4.0 |
4.0 |
2.0 |
|
③ |
8.0 |
V' |
4.0 |
4.0 |
2.0 |
表中V'= mL,理由是 。
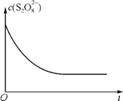
(3) 已知某条件下,浓度c(S2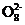 )-反应时间t的变化曲线如右图,若保持其他条件不变,请在右图中分别画出降低反应温度和加入催化剂时c(S2
)-反应时间t的变化曲线如右图,若保持其他条件不变,请在右图中分别画出降低反应温度和加入催化剂时c(S2 )-t的变化曲线示意图(进行相应的标注)。
)-t的变化曲线示意图(进行相应的标注)。
1. (2013·广东高考第31题节选)大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究。
(1) 在溶液中存在化学平衡:I2(aq) + I-(aq) 
 (aq),其平衡常数表达式为K= 。?
(aq),其平衡常数表达式为K= 。?
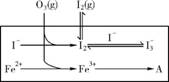
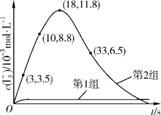
(2) 为探究Fe2+ 对O3氧化I-反应的影响(反应体系如上图),某研究小组测定两组实验中 浓度和体系pH,结果见下图和下表。
浓度和体系pH,结果见下图和下表。
|
编号 |
反应物 |
反应前pH |
反应后pH |
|
第1组 |
O3+I- |
5.2 |
11.0 |
|
第2组 |
O3+I-+Fe2+ |
5.2 |
4.1 |
①第1组实验中,导致反应后pH升高的原因是? 。
②反应体系图中的A为 ,由Fe3+生成A的过程能显著提高I-的转化率,原因是 。
③第2组实验进行18s后,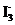 浓度下降。导致下降的直接原因有 (双选,填字母)。
浓度下降。导致下降的直接原因有 (双选,填字母)。
A. c(H+)减小 B. c(I-)减小
C. I2(g)不断生成 D. c(Fe3+)增加
0.21-x x
K= =
= =0.05
=0.05
x=0.0100mol
BaSO4被转化的质量为0.0100mol×233g·mol-1=2.33g
2. (1) BaSO4+4C BaS+4CO↑ (2)
硫酸(或H2SO4)
BaS+4CO↑ (2)
硫酸(或H2SO4)
(3) ①将适量饱和Na2CO3溶液加入BaSO4固体中,充分搅拌,静置,弃去上层清液,如此操作,反复多次(直到BaSO4完全转化为BaCO3)
②节能、环保等
③0.05
设BaSO4被转化的物质的量为x
BaSO4+C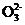
 BaCO3+S
BaCO3+S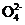
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com