
2. (1) ②2KHCO3 K2CO3+H2O+CO2↑
K2CO3+H2O+CO2↑
(2) ①B ②0.225mol·L-1·min-1 75% 降低温度(或加压或增大H2的量等)
(3) CO2(g)+4H2(g) CH4(g)+2H2O(l)
CH4(g)+2H2O(l)
ΔH1=-252.9kJ·mol-1
(4) Ba(OH)2 BaCO3的质量
1. (1) ①吸热 ②K=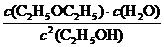 ad
ad
③大于 150175℃
(2) 升高温度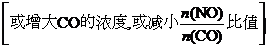 900℃
900℃
(3) 减小CO2的浓度
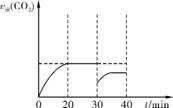
2. (1) K=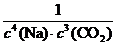 否
否
(2) 0.0015mol·L-1·min-1
(3) 增大压强,平衡向正反应方向(体积缩小的方向,生成金刚石的方向)移动
[典题演示]
变式训练1 (1) 1.9×10-4mol·L-1·s-1 25%
(2) K=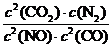
(3) CD
(4) ①分别验证温度、催化剂的比表面积对化学反应速率的影响规律
②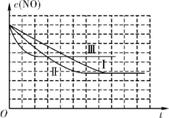
变式训练2 (1)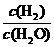
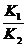
(2) CE
(3) ①0.075mol·L-1·min-1 ②1 ③增大
(4) 放热
(5)
[课堂评价]
1. (1) (2a+b)kJ·mol-1
(2) 用廉价的清洁能源供给热能
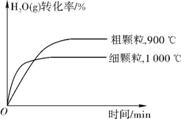
(3) ①细颗粒FeO表面积大,与H2O的接触面大,反应速率加快 ②相等
③900℃时,达到平衡FeO转化的物质的量为n(FeO)=0.60mol×40%=0.24mol
H2O(g)+3FeO(s) Fe3O4(s)+H2(g)
Fe3O4(s)+H2(g)
起始量/mol: 0.20 0.60 0 0
转化量/mol: 0.080 0.24 0.080 0.080
平衡量/mol: 0.12 0.36 0.080 0.080
K=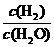 =
=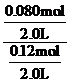 =0.67
=0.67
(4) 
4. (1) 升高温度,反应速率加快,平衡正向移动
(2) K=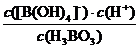
=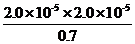 =5.7×10-10
=5.7×10-10
[高考前沿]
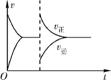
3. (1) vⅢ>vⅡ>vⅠ Ⅱ
(2) ① 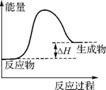 ②0.91
②0.91
2. (1) Na2S2O3 <2
(2) 2.0 保证反应物K2S2O8的浓度改变,而其他条件不变,才能达到实验目的
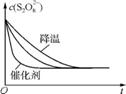
(3) 
1. (1) 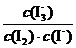
(2) ①由2I-(aq)+O3(g)+2H+(aq) I2(aq)+O2(g)+H2O(l)可知消耗H+,所以pH升高 ②Fe2+ 由于是持续通入O3,O3可以将Fe2+氧化成Fe3+,Fe3+氧化I-,I-消耗量增大,转化率增大 ③BD
I2(aq)+O2(g)+H2O(l)可知消耗H+,所以pH升高 ②Fe2+ 由于是持续通入O3,O3可以将Fe2+氧化成Fe3+,Fe3+氧化I-,I-消耗量增大,转化率增大 ③BD
2. (1) 温度、浓度、压强、催化剂等。
(2) ①看图像。一看图(即纵坐标与横坐标的意义),二看线(即线的走向和变化趋势),三看点(即起点、折点、交点、终点),四看辅助线(如等温线、等压线、平衡线等),五看量的变化(如浓度变化、温度变化等)。
②想规律、作判断。先拐先平:如在转化率-时间曲线中,先出现拐点的曲线先达到平衡(代表温度高、压强大);定一议二:图像中有三个量时,先确定一个量不变,再讨论另外两个量的关系。

趁热打铁,事半功倍。请同学们及时完成《配套检测与评估》中的练习第170-172页。
专题六 化学反应速率 化学平衡
[高考回眸]
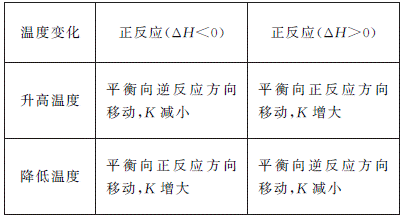
1. 化学平衡常数只是温度的函数,其随温度变化而变化。平衡常数可以用来判断化学反应的热效应:若正反应为吸热反应,温度升高,K增大;若正反应为放热反应,温度升高,K减小。具体如下:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com