
1. (2013·广州一模)某铜矿石中铜元素含量较低,且含有铁、镁、钙等杂质离子。某小组在实验室中用浸出-萃取法制备硫酸铜:

(1) 操作Ⅰ为 。操作Ⅱ用到的玻璃仪器有烧杯、 。
(2) 操作Ⅱ、操作Ⅲ的主要目的是 、富集铜元素。
(3) 某小组利用CuSO4溶液与Na2CO3溶液反应制备新型木材防腐剂Cu2(OH)2CO3。多次实验发现所得蓝色悬浊液颜色略有差异,查阅资料表明,可能由于条件控制不同使其中混有较多杂质Cu(OH)2或Cu4(OH)6SO4。
已知:Cu(OH)2、Cu2(OH)2CO3、Cu4(OH)6SO4均难溶于水,易溶于强酸;分解温度依次为80℃、200℃、300℃。
设计实验方案检验悬浊液成分,完成表中内容。
限选试剂:2mol·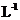 盐酸、1mol·
盐酸、1mol·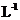 H2SO4溶液、0.1mol·
H2SO4溶液、0.1mol·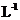 NaOH溶液、0.1mol·
NaOH溶液、0.1mol·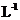 BaCl2溶液、蒸馏水。仪器和用品自选。
BaCl2溶液、蒸馏水。仪器和用品自选。
|
实验步骤 |
预期现象和结论 |
|
步骤1:取少量悬浊液样品于试管中,过滤,充分洗涤后,取滤渣于试管中, |
,说明产品中混有
Cu4(OH)6SO4 |
|
步骤2:另取少量悬浊液样品于试管中,牋 |
,说明产品中混有
Cu(OH)2 |
(4) 上述实验需要100mL0.5mol·L-1CuSO4溶液,配制时需称取 gCuSO4·5H2O。
4. (2010·广东高考第33题)某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(1) 请完成SO2与过量NaOH溶液反应的化学方程式:SO2+2NaOH 。
。
(2) 反应Cl2+Na2SO3+2NaOH 2NaCl+Na2SO4+H2O中的还原剂为 。
2NaCl+Na2SO4+H2O中的还原剂为 。
(3) 吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和S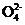 。请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中CO2的影响)。
。请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中CO2的影响)。
①提出合理假设
假设1:只存在S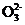 ;
;
假设2:既不存在S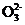 ,也不存在ClO-;
,也不存在ClO-;
假设3: 。
②设计实验方案,进行实验。请写出实验步骤以及预期现象和结论。限选实验试剂:3mol·L-1H2SO4、1mol·L-1NaOH溶液、0.01mol·L-1KMnO4溶液、淀粉-KI溶液、紫色石蕊试液。
|
实验步骤 |
预期现象和结论 |
|
步骤1:取少量吸收液于试管中,滴加3mol·L-1
H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中 |
|
|
步骤2: |
|
|
步骤3: |
|
3. (2011·广东高考第33题)某同学进行实验研究时,欲配制1.0mol·L-1Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2·8H2O试剂。在室温下配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物。为探究原因,该同学查得Ba(OH)2·8H2O 在283 K、293 K和303 K时的溶解度(g/100 g H2O)分别为2.5、3.9和5.6。
(1) 烧杯中未溶物可能仅为BaCO3,理由是 。
(2) 假设试剂由大量Ba(OH)2·8H2O和少量BaCO3组成,设计实验方案,进行成分检验。写出实验步骤、预期现象和结论。(不考虑结晶水的检验;室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管。
|
实验步骤 |
预期现象和结论 |
|
步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀 |
|
|
步骤2:取适量滤液于试管中,滴加稀硫酸 |
|
|
步骤3:取适量步骤1中的沉淀于试管中, |
|
|
步骤4: |
|
(3) 将试剂初步提纯后,准确测定其中Ba(OH)2·8H2O的含量。实验如下:
①配制250mL约0.1mol·L-1Ba(OH)2溶液:准确称取w g试样,置于烧杯中,加适量蒸馏水, ,将溶液转入 ,洗涤,定容,摇匀。
②滴定:准确量取25.00mL所配制Ba(OH)2溶液于锥形瓶中,滴加指示剂,将 (填“0.020”、“0.05”、“0.1980”或“1.5”)mol·L-1盐酸装入50mL酸式滴定管,滴定至终点,记录数据。重复滴定2次。平均消耗盐酸VmL。
③计算Ba(OH)2·8H2O的质量分数= (只列出算式,不做运算)。
(4) 室温下, (填“能”或“不能”) 配制1.0mol·L-1Ba(OH)2溶液。
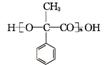
2. (2012·广东高考第33题)苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,反应原理:
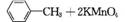
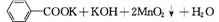
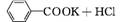

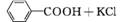
实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
反应混合物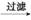 滤液
滤液

已知:苯甲酸的相对分子质量为122,熔点为122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物都有固定熔点。
(1) 操作Ⅰ为 ,操作Ⅱ为 。
(2) 无色液体A是 ,定性检验A的试剂是 ,现象是 。
(3) 测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。请完成表中内容。
|
序号 |
实验方案 |
实验现象 |
结论 |
|
① |
将白色固体B加入水中,加热溶解, |
得到白色晶体和无色溶液 |
|
|
② |
取少量滤液于试管中, |
生成白色沉淀 |
滤液含Cl- |
|
③ |
干燥白色晶体, |
|
白色晶体是苯甲酸 |
(4)纯度测定:称取1.220g产品,配成100mL甲醇溶液,移取25.00mL溶液,滴定,消耗KOH的物质的量为2.40×10-3mol,产品中苯甲酸质量分数的计算表达式为 ,计算结果为 (保留两位有效数字)。
1. (2013·广东高考第33题)化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。
(1) 在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。
①下列收集Cl2的正确装置是 (填字母)。
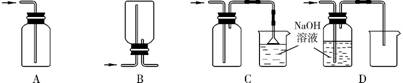
②将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是 。
③设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中,
。
(2) 能量之间可以相互转化:电解食盐水制备Cl2是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。

限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。
①完成原电池的甲装置示意图(见右图),并作相应标注。
要求:在同一烧杯中,电极与溶液含相同的金属元素。
②以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极 。
③甲、乙两种原电池中可更有效地将化学能转化为电能的是 ,其原因是 。
(3) 根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在(2) 的材料中应选 作阳极。
2. (1) C8H8O2
(2) 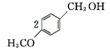 +O2
+O2
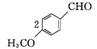 +2H2O
+2H2O
(3) 
(4) AD
(5) 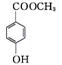 (或
(或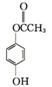 或
或 )
)
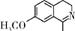
(6) 
1. (1) C17H22O2
(2) Br2+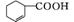


(3) 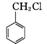 取代反应
取代反应
(4) 
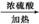
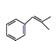 +H2O
+H2O
(5) 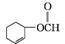 、
、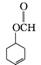 、
、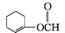
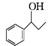
(6) 
2. (1) C10H10O2 4
(2) 2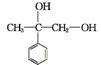 +O2
+O2 2
2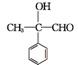 +2H2O
+2H2O
(3) n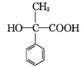
 +nH2O
+nH2O
[或n
 +(n-1)H2O]
+(n-1)H2O]
(4)  或
或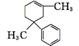
(5) ②④
[典题演示]
变式训练1 (1) C8H11O2N 4
(2) 加成反应 还原反应
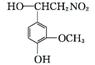

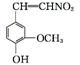 +H2O
+H2O
(3) 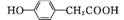
变式训练2 (1) 羧基 D
(2) 酯化反应(或取代反应)
(3) CH3COOCH(CH3)2 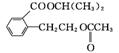
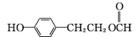
(4) 
(5) 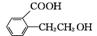

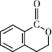 +H2O
+H2O
变式训练3 (1) C5H10O2 羟基 (2)
CH3COOH+CH3CH2CH2OH CH3COOCH2CH2CH3+H2O
CH3COOCH2CH2CH3+H2O
(3) n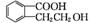

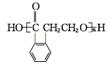 +(n-1)H2O
+(n-1)H2O
(4) 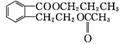
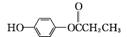
(5) 
变式训练4 (1) 酚羟基 醚键
(2) C8H11O2N
(3) ①③ 浓硫酸、加热
(4) 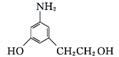 (或
(或 )
)
(5) 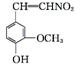 +2Br2
+2Br2
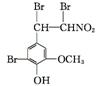 +HBr
+HBr
[课堂评价]
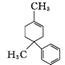
1. (1) C13H20 18
(2) 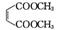 +2H2O
+2H2O
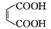 +2CH3OH
+2CH3OH
(3) 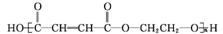
(4)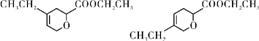
(5) BCD
4. (1) C8H8 10
(2) 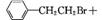 NaOH
NaOH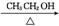
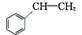 +NaBr+H2O
+NaBr+H2O
(3) 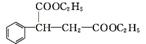
(4) 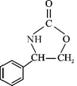 或
或 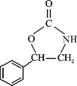
(5) AB
[高考前沿]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com