
4. (1) Na2SO3+H2O (2) Na2SO3 (3) ①只存在ClO-
②
|
实验步骤 |
预期现象和结论 |
|
步骤1:取少量吸收液于试管中,滴加3mol·L-1H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中 |
|
|
步骤2:向A试管中滴加12滴0.01mol·L-1KMnO4溶液 |
(1) 若溶液褪色,则假设1成立;(2) 若溶液未褪色,则假设2或3成立 |
|
步骤3:在B试管中滴加12滴淀粉-KI溶液 |
(1) 若溶液变蓝色,则假设3成立;(2)若溶液不变蓝色,结合步骤2中的(2),则假设2成立 |
[高考前沿]
3. (1) 由于Ba(OH)2·8H2O与空气中的CO2反应,所取试剂大部分已变质为BaCO3,未变质的Ba(OH)2·8H2O在配制溶液时能全部溶解
(2)
|
实验步骤 |
预期现象和结论 |
|
步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀 |
|
|
步骤2:取适量滤液于试管中,滴加稀硫酸 |
出现白色沉淀,说明该试剂中有Ba2+存在 |
|
步骤3:取适量步骤1中的沉淀于是试管中,滴加稀盐酸,连接带塞导气管将产生的气体导入澄清石灰水中 |
澄清石灰水变浑浊,说明该试剂中含有BaCO3 |
|
步骤4:取步骤1中的滤液于烧杯中,用pH计测定其pH |
pH明显大于9.6,说明该试剂中含有Ba(OH)2 |
(3) ①搅拌溶解、过滤 250mL容量瓶中 ②0.1980
③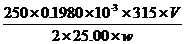 ×100%
×100%
(4) 不能
2. (1) 分液 蒸馏
(2) 甲苯 酸性KMnO4溶液 紫色溶液褪色
(3)
|
序号 |
实验方案 |
实验现象 |
结论 |
|
① |
将白色固体B加入水中,加热溶解,冷却、过滤 |
得到白色晶体和无色溶液 |
|
|
② |
取少量滤液于试管中,滴入适量的硝酸酸化的AgNO3溶液 |
生成白色沉淀 |
滤液含Cl- |
|
③ |
干燥白色晶体,加热使其熔化,测其熔点 |
熔点为122.4℃ |
白色晶体是苯甲酸 |
(4) 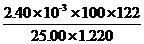 ×100% 96%
×100% 96%
1. (1) ①C
②Cl2、HClO、ClO-
③加入适量的NaBr溶液,充分振荡,静置。溶液分层,下层液体为橙红色
(2) ①见图示
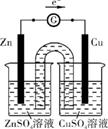
②电极逐渐溶解
③甲 可以避免活泼金属如Zn和CuSO4的接触,从而提供稳定电流
(3) Zn
2.
|
方 法 |
规律与技巧 |
|
差量法 |
根据物质变化前后某种量发生变化的化学方程式或关系式,找出所谓“理论差量”,这个差量可以是质量差、气态物质的体积差、压强差,也可以是物质的量之差、反应过程中的热量差等。该法适用于解答混合物间的反应,且反应前后存在上述差量的反应体系 |
|
守恒法 |
化学反应中存在一系列守恒现象,如质量守恒、元素守恒、电荷守恒、电子得失守恒等,利用这些守恒关系解题的方法叫做守恒法。质量守恒就是化学反应前后各物质的质量总和不变,在配制或稀释溶液的过程中,溶质的质量不变。元素守恒即反应前后各元素种类不变,各元素原子个数不变,其物质的量、质量也不变。电荷守恒即对任一电中性的体系,如化合物、混合物、溶液等,正、负电荷的代数和为零,即正电荷总数和负电荷总数相等。电子得失守恒是指在发生氧化还原反应时,氧化剂得到的电子数一定等于还原剂失去的电子数,无论是自发进行的氧化还原反应还是原电池或电解池中均如此 |
|
关系式法 |
对于多步反应体系,依据若干化学方程式,找出起始物质与最终物质的量的关系,并据此列比例式进行计算求解方法,称为“关系式”法。用关系式解题的关键是建立关系式,建立关系式的方法主要有:①利用微粒守恒关系建立关系式;②利用化学方程式中的化学计量数间的关系建立关系式;③利用化学方程式的加合建立关系式 |
|
平均值法 |
所谓平均值法是一种将数学平均原理应用于化学计算的解题方法。它所依据的数学原理是:两个数Mr和Mr'(Mr>Mr')的算术平均值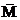 r,一定介于两者之间。常见方法有:求平均相对原子质量、平均相对分子质量、平均摩尔质量、平均组成等 r,一定介于两者之间。常见方法有:求平均相对原子质量、平均相对分子质量、平均摩尔质量、平均组成等 |
|
极端假设法 |
“极端假设法”是用数学方法解决化学问题的常用方法,一般解答有关混合物计算时采用,可分别假设原混合物是某一纯净物,进行计算,确定最大值、最小值,再进行分析、讨论、得出结论 |
|
讨论法 |
有一类化学计算题,由于某一条件的不确定,结果可能是两个或两个以上,也可能在某个范围内取值,这类题需要用讨论的方法求解。常见的类型:①讨论反应发生的程度;②讨论反应物是否过量;③讨论反应物或生成物的组成范围;④讨论不定方程式的解 |

趁热打铁,事半功倍。请同学们及时完成《配套检测与评估》中的练习第187-190页。
专题十二 化学实验探究综合题型研究
[高考回眸]
1. 实验路线的优选;仪器和药剂的选择;实验装置的组合;操作程序的编排及条件的控制;数据的测量等。
2. (2013·广州调研)大型钢铁企业酸洗钢材时产生的废液主要成分为Fe2+、H+、Cl-,可用下述方法处理该废液,回收盐酸,制备氧化铁涂料。
废液
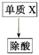
 过滤
过滤
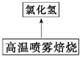
 氧化铁粉末
氧化铁粉末
(1) 单质X的化学式是 。
(2) 氯化亚铁溶液经高温喷雾焙烧时转化为氯化氢气体和氧化铁粉末。有关的化学方程式为 。
(3) 某种铁红涂料的成分中,除含有Fe2O3外,还添加有CuO或FeO中的一种。请设计实验探究该铁红涂料中添加的物质。
①提出合理假设
假设1:添加了CuO。
假设2:添加了FeO。
②基于假设 (填“1”或“2”),设计实验方案,进行实验。写出实验步骤、预期现象和结论。
限选实验试剂:铁粉、3mol·L-1H2SO4溶液、0.01mol·L-1酸性KMnO4溶液、10%NaOH溶液、10%H2O2、KSCN溶液。
|
实验步骤 |
预期现象和结论 |
|
步骤1.取少量样品于试管中, |
|
|
步骤2.
|
|
(4) 用水吸收“高温喷雾焙烧”时产生的氯化氢气体可得到盐酸。请计算:用1000g水需吸收标准状况下多少升氯化氢气体可得到36.5%的浓盐酸(写出计算过程,结果可用数学表达式表示,不必化简)。
[问题思考]提示
7.84g铁触媒 溶液A
溶液A 溶液B
溶液B
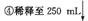
计算铁的含量 取25.00mL稀释后溶液
取25.00mL稀释后溶液
(1) 步骤④中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和 。
(2) 因为通入Cl2不足量,“溶液B”中还含有 会影响测定结果。
(3) 因为通入Cl2过量且加热煮沸不充分,“溶液B”中可能含有Cl2。请设计实验方案检验Cl2,完成下列实验报告。
限选试剂:0.1mol·L-1酸性KMnO4溶液、紫色石蕊试液、品红稀溶液、淀粉-KI溶液、0.1mol·L-1KSCN溶液。
|
实验操作 |
实验现象与结论 |
|
|
|
(4) “干燥管C”的作用是 。
1. (2013·深圳二模)铁触媒(铁的氧化物)是硫酸工业的催化剂。某同学设计了以下两种方案研究铁触媒的组成。
方案一:用下列装置测定铁触媒的含铁量,确定其组成。

方案二:用下列实验方法测定铁触媒的含铁量,确定其组成。
2. (2013·深圳一模)工业上用异丙苯氧化法合成苯酚,其生产流程如下图:
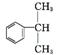
 液态混合物
液态混合物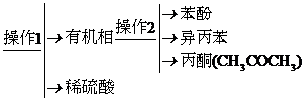
有关物质的性质如下表:
|
物质 |
沸点 |
溶解性 |
主要化学性质 |
|
异丙苯 |
152.4℃ |
不溶于水,易溶于酒精 |
可被强氧化剂氧化 |
|
苯酚 |
181.8℃ |
微溶于冷水,易溶于热水和酒精等有机溶剂 |
易被氧化 |
|
丙酮 |
56.2℃ |
易溶于水和有机溶剂 |
不易被氧化 |
(1) 检验有机相中是否含有水的方法是 。
(2) “操作2”的名称是 。
(3) 丙酮中常含有苯酚和异丙苯中的一种或者两种有机物杂质,某同学做了如下检验:
|
检验项目 |
实验方案 |
|
检验丙酮中一定存在有机物杂质的方法是 |
A. 酸性KMnO4溶液,加热 B. 乙醇,溶解 C. NaOH溶液(酚酞),加热 |
|
检验丙酮中是否含有苯酚 |
取少许待测液置于试管中,滴加12滴FeCl3溶液。预期的实验现象和结论是 |
(4)某同学对该厂废水进行定量分析。取20.00mL废水于锥形瓶中,水浴加热,用0.1000mol·L-1酸性KMnO4溶液滴定(假定只有苯酚与KMnO4反应)。达到滴定终点时,消耗KMnO4溶液的体积为10.00mL。有关反应的化学方程式如下:
5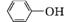 +28KMnO4+42H2SO4
+28KMnO4+42H2SO4
 28MnSO4+14K2SO4+30CO2↑+57H2O
28MnSO4+14K2SO4+30CO2↑+57H2O
①滴定终点的现象为 。
②该废水中苯酚的含量为 mg·mL-1。(保留两位有效数字)

|
1. 实验方案设计一般包括哪几个方面 |
|
2. 化学计算的常用方法有哪些 |
|
|

课堂评价
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com