
4. D
[典题演示]
变式训练1 A
变式训练2 C
变式训练3 A
变式训练4 B
[课堂评价]
3. CD
2. D
1. C
4. C
[高考前沿]
3. AD
2. BD
1. BD
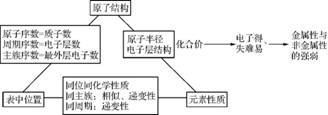
2. 元素的原子结构决定了元素在周期表中的位置,元素在周期表中的位置反映了元素的原子结构和元素的性质特点。元素“位置-结构-性质”三者之间的关系如下:

趁热打铁,事半功倍。请同学们及时完成《配套检测与评估》中的练习第165166页。
专题四 元素周期律
[高考回眸]
1. (1) 用原子结构理论来解释同一周期元素(稀有气体元素除外)性质的变化规律:同一周期元素的原子,核外电子层数相同,从左到右随着核电荷数的递增,最外层电子数逐渐增加,原子核与最外层上的电子之间的吸引力逐渐增强。所以,原子半径逐渐减小;元素的原子得电子的能力逐渐增强,失电子的能力逐渐减弱,金属性逐渐减弱,非金属性逐渐增强。
(2) 用原子结构理论来解释同一主族元素性质的变化规律:同一主族元素的原子,最外电子层上的电子数相同,所以性质具有相似性。由于它们自上而下随着核电荷数的增大,电子层数逐渐增加,原子半径逐渐增大,原子核与最外层上的电子之间的吸引力逐渐减弱。所以,元素的原子得电子的能力逐渐减弱,失电子的能力逐渐增强,金属性逐渐增强,非金属性逐渐减弱。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com