
3. (1) 4C+4Cl2+ZrSiO4 ZrCl4+SiCl4+4CO(3分)
ZrCl4+SiCl4+4CO(3分)
(2) ZrOCl2·8H2O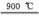 ZrO2+2HCl↑+7H2O↑(3分)
ZrO2+2HCl↑+7H2O↑(3分)
(3) B(2分)
(4) 负(2分) O2+4e- 2O2-(2分)
2O2-(2分)
C4H10-26e-+13O2- 4CO2+5H2O(3分)
4CO2+5H2O(3分)
2. (1) 除去废催化剂中的活性炭(2分) 除去铁、锌等杂质(2分)
(2) 防止硝酸分解,防止盐酸、硝酸挥发(2分)
(3) NaNO3(2分)
(4) 酸性条件下,甲醛会被硝酸氧化(2分)
(5) 过滤(1分) HCOO-(1分)
(6) C+4HNO3(浓) CO2↑+4NO2↑+2H2O(3分)
CO2↑+4NO2↑+2H2O(3分)
1. (1) Mg(OH)2(2分) CaCO3(2分)
(2) NaHCO3(2分)
(3) 除去HC (3分) NaCl(2分)
(3分) NaCl(2分)
(4) NaHCO3+SO2 NaHSO3+CO2(4分)
NaHSO3+CO2(4分)
8. (15分)KNO3是重要的化工产品,下面是一种已获得专利的KNO3制备方法的流程图:
(1) 反应Ⅰ的化学方程式为CaSO4+2NH4HCO3 CaCO3↓+(NH4)2SO4+H2O+CO2↑,则反应Ⅳ的化学方程式为 。
CaCO3↓+(NH4)2SO4+H2O+CO2↑,则反应Ⅳ的化学方程式为 。
(2) 反应Ⅱ需在干态、加热的条件下进行,加热的目的是 ;
从反应Ⅳ所得混合物中分离出CaSO4的方法是趁热过滤,趁热过滤的目的是 。
(3) 检验反应Ⅱ所得K2SO4中是否混有KCl的方法是取少量K2SO4样品溶于水,
。
(4) 整个流程中,可循环利用的物质除(NH4)2SO4外,还有 (填化学式)。
化学工艺流程综合训练
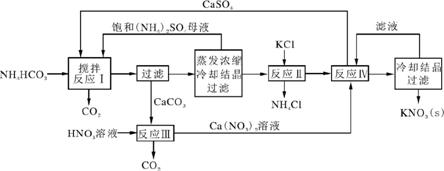
7. (15分)(2013·番禺统测)回收再利用锗产品加工废料,是生产GeO2的重要途径,其流程如下图。
(1) Ge2+与氧化剂H2O2反应生成Ge4+,写出该反应的离子方程式: 。
(2) 蒸馏可获GeCl4,在此过程中加入浓盐酸的原因是 。
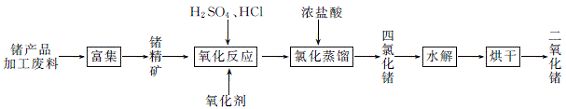
(3) GeCl4水解生成GeO2·nH2O,化学方程式为 。温度对GeCl4的水解率产生的影响如下图所示,其原因是该水解反应的ΔH (填“>”或“<”)0。为控制最佳的反应温度,实验时可采取的措施为 (填字母)水浴。
A. 用冰水混合物 B. 49℃水 C. 用冰盐水
(4) 已知Ge的单质和化合物性质与Al的相似,试用离子方程式表示在pH>8的溶液中GeO2逐渐溶解时发生的反应: 。
6. (15分)(2013·番禺三模)2006年世界锂离子电池总产量超过25亿只,锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的。因此锂离子电池回收具有重要意义,其中需要重点回收的是正极材料,其主要成分为钴酸锂(LiCoO2)、导电乙炔黑(一种炭黑)、铝箔以及有机粘接剂。某回收工艺流程如下:
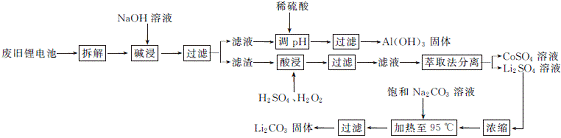
(1) 上述工艺回收到的产物有 。
(2) 废旧电池可能由于放电不完全而残留有原子态的锂,为了安全对拆解环境的要求是 。
(3) 碱浸时主要反应的离子方程式为 。
(4) 酸浸时反应的化学方程式为 。如果用盐酸代替H2SO4和H2O2的混合液也能达到溶解的目的,但不利之处是 。
(5) 生成Li2CO3的化学方程式为 。已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应 。
5. (15分)(2013·湛江二模)以白云石(化学式表示为MgCO3·CaCO3)为原料制备Mg(OH)2的工艺流程如下图所示。
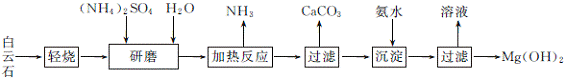
(1) 研磨的作用是 。
(2) 该工艺中可循环使用的物质是 、 (填化学式)。
(3) 白云石轻烧的主要产物是MgO·CaCO3,而传统工艺是将白云石加热分解为MgO和CaO后提取,白云石轻烧的优点是 。
(4) 加热反应的离子方程式为 。
(5) ①加热反应时,在323K和353K溶液中c(N )与反应时间的关系如下图中所示,请在下图中画出373K的曲线。
)与反应时间的关系如下图中所示,请在下图中画出373K的曲线。
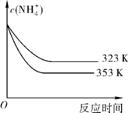
②由图可知,随着温度升高, 。
4. (15分)(2013·佛山二模)工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:
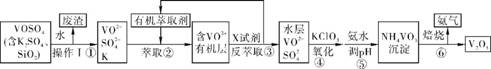
请回答下列问题:
(1) 步骤①所得废渣的成分是 (填化学式),操作Ⅰ的名称 。
(2) 步骤②、③的变化过程可简化如下:(R表示VO2+,HA表示有机萃取剂)
R2(SO4)n(水层)+2nHA(有机层) 2RAn(有机层)+nH2SO4(水层)
2RAn(有机层)+nH2SO4(水层)
②中萃取时必须加入适量碱,其原因是 。
③中X试剂为 。
(3) ⑤的离子方程式为 。
(4) 该工艺流程中,可以循环利用的物质有 和 。
3. (15分)(2013·汕头一模)锆产业是极有发展潜力及前景的新兴产业,锆(Zr)元素是核反应堆燃料棒的包裹材料,二氧化锆(ZrO2)可以制造耐高温纳米陶瓷。我国有丰富的锆英石(ZrSiO4),含Al2O3、SiO2、Fe2O3等杂质,生产锆的流程之一如下:
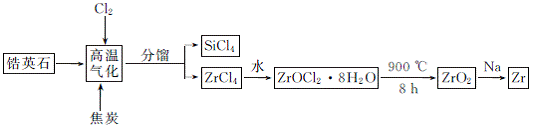
试回答下列问题:
(1) 写出上述流程中高温气化的化学方程式: (碳转化成CO)。
(2) 写出ZrOCl2·8H2O在900℃ 生成ZrO2的化学方程式: 。
(3) 关于二氧化锆纳米陶瓷和锆合金的说法不正确的是 (填字母)。
A. 二氧化锆纳米陶瓷是新型无机非金属材料
B. 1nm=10-10m
C. 锆合金的硬度比纯锆要高
D. 日本福岛核电站的爆炸可能是由锆合金在高温下与水蒸气反应产生的氢气爆炸引起的
(4) 一种新型燃料电池,一极通入空气,另一极通入丁烷;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。在熔融电解质中,O2-向 (填“正”或“负”)极移动。电池正极的电极反应式为 ,负极的电极反应式为 。
2. (15分)(2013·惠州一中模拟)工业上从废催化剂(主要成分是钯和活性炭,还含有少量铁、锌)中回收钯,采用如下流程:
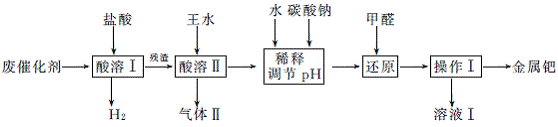
已知:钯(Pd)的性质与铂相似。钯与王水在加热条件下发生的主要反应如下:
3Pd+12HCl+2HNO3 3H2PdCl4+2NO↑+4H2O
3H2PdCl4+2NO↑+4H2O
请回答下列问题:
(1) 酸溶Ⅰ前先将废催化剂在700℃下进行灼烧,同时不断通入空气的作用是 。加入盐酸的目的是 。
(2) 酸溶Ⅱ需控制温度不宜过高,除了控制一定反应速率外,其原因是 。
(3) 若用足量的烧碱吸收混有空气的气体Ⅱ,吸收后溶液中含有溶质的化学式有NaOH、NaNO2、 。
(4) 使用甲醛还原钯的化合物时,溶液需要保持碱性,否则会造成甲醛的额外损耗,原因是 。
(5) 操作Ⅰ的名称是 ,溶液Ⅰ可能含有的有机离子为 。
(6) 催化剂中另一主要成分活性炭可以用浓硝酸除去,写出该反应的化学方程式: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com