
5. (16分)(2013·珠海一中联考)
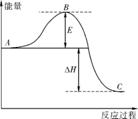
Ⅰ. 2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如右图所示。请回答下列问题:
2SO3(g)反应过程的能量变化如右图所示。请回答下列问题:
(1)图中C表示 。
(2)E的大小对该反应的焓变有无影响 (填“有”或“无”)。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低 (填“升高”或“降低”)。
Ⅱ. 化学试剂的生产和电镀工业排放的废水中常含有20100mg·L-1Cr(+6价),饮用含Cr(+6价)的水会损害人的肠胃等。工业上常用化学法和电解法处理含Cr(+6价)废水,使Cr(+6价)转变为Cr(+3价),再将Cr(+3价)转化成沉淀除去。某研究性学习小组为研究废水的净化,设计了如下实验流程:
含Cr2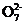 的酸性的废水
的酸性的废水 含Cr3+、Fe2+、Fe3+的溶液
含Cr3+、Fe2+、Fe3+的溶液

(1)配平第①步反应的离子方程式:
Cr2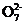 + Fe2++ H+—— Cr3++ Fe3++
+ Fe2++ H+—— Cr3++ Fe3++
(2)第②步中用pH试纸测定溶液pH的具体操作:
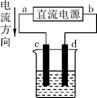
(3)设计一个电解装置也可以实现上述目的,装置如右图(用铁棒和石墨作电极),电解液是含Cr2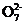 的酸性溶液。铁棒电极放电生成Fe2+进入溶液,Fe2+将Cr2
的酸性溶液。铁棒电极放电生成Fe2+进入溶液,Fe2+将Cr2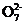 还原成Cr3+。(阴极区得电子的主要不是Cr2
还原成Cr3+。(阴极区得电子的主要不是Cr2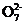 )
)
电极材料: c为 (填“铁棒”或“石墨”)。
电极反应: d极 。
4. (16分)(2013·广雅中学最后一模)工业上采用乙苯脱氢制备苯乙烯,反应体系同时发生两步可逆反应,其能量变化情况如下:

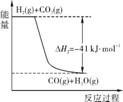
(1) 总反应 (g)+CO2(g)
(g)+CO2(g)
 (g)+CO(g)+H2O(g)的ΔH= 。
(g)+CO(g)+H2O(g)的ΔH= 。
(2) 下列叙述不能说明反应体系已达到平衡状态的是 (填字母)。
a. v正(CO)=v逆(CO) b. c(CO2)=c(CO)
c. 消耗1molCO2同时生成1molH2O d. 混合气体的平均相对分子质量保持不变
(3) 某化学兴趣小组欲探究在相同压强条件下,CO2用量和温度条件对乙苯脱氢反应的影响,并设计了如下实验:
|
实验编号 |
乙苯/mol |
CO2/mol |
He/mol |
温度/
℃ |
|
Ⅰ |
3.0 |
9.0 |
0 |
550 |
|
Ⅱ |
3.0 |
9.0 |
0 |
600 |
|
Ⅲ |
3.0 |
0 |
a |
550 |

①表中a= mol,理由是 。
②经实验测得,三组实验中乙苯的转化随时间变化如右上图所示。其中未知曲线代表的是实验(填“Ⅱ”或“Ⅲ”)。请用平衡移动原理解释该条件改变对乙苯转化率产生影响的原因: 。
③在右上图中补画剩余实验的变化曲线,并进行必要的标注。
3. (16分)(2013·番禺二模)已知:将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生。若再加入双氧水,将发生反应:H2O2+2H++2I- 2H2O+I2,且生成的I2立即与试剂X反应而被消耗。一段时间后,试剂X将被反应生成的I2完全消耗。由于溶液中的I-继续被H2O2氧化,生成的I2与淀粉作用,溶液立即变蓝。因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算反应H2O2+2H++2I-
2H2O+I2,且生成的I2立即与试剂X反应而被消耗。一段时间后,试剂X将被反应生成的I2完全消耗。由于溶液中的I-继续被H2O2氧化,生成的I2与淀粉作用,溶液立即变蓝。因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算反应H2O2+2H++2I- 2H2O+I2的反应速率。下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
2H2O+I2的反应速率。下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
|
编 号 |
往烧杯中加入的试剂及其用量/mL |
催化剂 |
开始变蓝时间/min |
||||
|
0.1
mol·L-1 KI溶液 |
H2O |
0.01
mol·L-1 X溶液 |
0.1
mol·L-1 双氧水 |
1
mol·L-1 稀盐酸 |
|||
|
1 |
20.0 |
10.0 |
10.0 |
20.0 |
20.0 |
无 |
1.4 |
|
2 |
20.0 |
m |
10.0 |
10.0 |
n |
无 |
2.8 |
|
3 |
10.0 |
20.0 |
10.0 |
20.0 |
20.0 |
无 |
2.8 |
|
4 |
20.0 |
10.0 |
10.0 |
20.0 |
20.0 |
5滴Fe2(SO4)3 |
0.6 |
(1) 已知:实验1、2的目的是探究H2O2浓度对H2O2+2H++2I- 2H2O+I2反应速率的影响。实验2中m= ,n= 。
2H2O+I2反应速率的影响。实验2中m= ,n= 。

(2) 已知,I2与X反应时,两者物质的量之比为2∶1。按表格中的X和KI的加入量,加入V(H2O2)> ,才确保看到蓝色。
(3) 实验1,浓度c(X)-t的变化曲线如右图,若保持其他条件不变,请在坐标图中,分别画出实验3、实验4中c(X)-t的变化曲线图(进行相应的标注)。
(4) 实验4表明:硫酸铁能提高反应速率。催化剂能加快反应速率是因为催化剂 (填“提高”或“降低”)了反应活化能。
2. (16分)(2013·佛山南海摸底)乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理如下:
2CO(g)
+ 4H2(g) CH3CH2OH(g)
+ H2O(g) ΔH1
CH3CH2OH(g)
+ H2O(g) ΔH1
已知:H2O(l) H2O(g)
ΔH2
H2O(g)
ΔH2
CO(g) + H2O(g) CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
(1)以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:
2CO2(g) +6H2(g) CH3CH2OH(g)
+3H2O(l) ΔH = 。
CH3CH2OH(g)
+3H2O(l) ΔH = 。
(2)CH4和H2O在催化剂表面发生反应CH4+H2O CO+3H2,该反应在不同温度下的化学平衡常数如下表:
CO+3H2,该反应在不同温度下的化学平衡常数如下表:
|
温度/℃ |
800 |
1000 |
1200 |
1400 |
|
平衡常数 |
0.45 |
1.92 |
276.5 |
1771.5 |
①该反应是 (填“吸热”或“放热”)反应。
②T℃时,向1 L密闭容器中投入1mol CH4和1mol H2O(g),5h后测得反应体系达到平衡状态,此时c(CH4)=0.5mol·L-1,计算该温度下CH4+H2O CO+3H2的平衡常数K= ,
CO+3H2的平衡常数K= ,
该温度下达到平衡时H2的平均生成速率为 。
(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如下图所示。

①若不使用CO,温度超过775℃,发现NO的转化率降低,其可能的原因为 ;在 =1的条件下,应控制的最佳温度在 左右。
=1的条件下,应控制的最佳温度在 左右。
②用CxHy(烃)催化还原也可消除氮氧化物的污染。写出CH4与NO2发生反应的化学方程式: 。

(4)乙醇同时也是工业生产乙醛等化工产品的重要原料,右图是乙醇氧化为乙醛的反应机理,则B物质应为 。
1. (16分)(2013·江门调研改编)重晶石(BaSO4)是重要的化工原料。用重晶石制备氢氧化钡晶体[Ba(OH)2·8H2O]的流程如下:
重晶石 BaS、CO
BaS、CO 滤液
滤液 BaCl2溶液
BaCl2溶液 Ba(OH)2·8H2O
Ba(OH)2·8H2O
已知:Ba(s)+S(s)+2O2(g) BaSO4(s) ΔH=-1473.2kJ·mol-1
BaSO4(s) ΔH=-1473.2kJ·mol-1
2C(s)+O2(g) 2CO(g) ΔH=-221kJ·mol-1
2CO(g) ΔH=-221kJ·mol-1
Ba(s)+S(s) BaS(s) ΔH=-460kJ·mol-1
BaS(s) ΔH=-460kJ·mol-1
(1) 写出煅烧时发生反应的热化学方程式: 。
(2) 写出氢氧化钡晶体与氯化铵晶体混合反应的化学方程式: 。
(3) 为检测煅烧时产生的CO,可将煅烧产生的气体通入PbCl2溶液中,出现黑色沉淀和产生一种无色无味能使澄清石灰水变浑浊的气体,试写出该反应的化学方程式: 。
(4) 向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3。发生的反应可表示为BaSO4(s)+C (aq)
(aq) BaCO3(s)+S
BaCO3(s)+S (aq)。试从平衡的角度解释BaSO4可转化为BaCO3的原因: 。
(aq)。试从平衡的角度解释BaSO4可转化为BaCO3的原因: 。
8. (1) Ca(NO3)2+K2SO4 CaSO4↓+2KNO3(3分)
CaSO4↓+2KNO3(3分)
(2) 分离NH4Cl与K2SO4,加快化学反应速率(3分) 防止KNO3结晶,提高KNO3的产率(3分)
(3) 加入Ba(NO3)2溶液至不再产生沉淀,静置,向上层清液中滴加AgNO3溶液,若无白色沉淀生成,说明K2SO4中不混有KCl;若有白色沉淀生成,说明K2SO4中混有KCl(3分)
(4) CaSO4、KNO3(3分)
7. (1) Ge2++H2O2+2H+ Ge4++2H2O(3分)
Ge4++2H2O(3分)
(2) 抑制GeCl4水解(2分)
(3) GeCl4+(n+2)H2O GeO2·nH2O+4HCl(3分) <(2分) C(2分)
GeO2·nH2O+4HCl(3分) <(2分) C(2分)
(4) GeO2+2OH- Ge
Ge +H2O(3分)
+H2O(3分)
6. (1) Al(OH)3、CoSO4、Li2CO3(3分)
(2) 隔绝空气和水分(2分)
(3) 2Al+2OH-+2H2O 2Al
2Al +3H2↑(2分)
+3H2↑(2分)
(4) 2LiCoO2+H2O2+3H2SO4 Li2SO4+2CoSO4+O2↑+4H2O(2分) 有氯气生成,污染较大(2分)
Li2SO4+2CoSO4+O2↑+4H2O(2分) 有氯气生成,污染较大(2分)
(5) Li2SO4+Na2CO3 Na2SO4+Li2CO3↓(2分) 趁热(2分)
Na2SO4+Li2CO3↓(2分) 趁热(2分)
5. (1) 增大固体的表面积,加快反应速率,增大原料利用率(2分)
(2) NH3(2分) (NH4)2SO4(2分)
(3) 减少能耗、减少CO2的排放等(2分)
(4) MgO+2N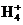
 Mg2++2NH3↑+H2O(3分)
Mg2++2NH3↑+H2O(3分)
(5) ①见下图(2分)

②反应的时间缩短、平衡时c(N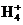 )减小(2分)
)减小(2分)
4. (1) SiO2(2分) 过滤(2分)
(2) 加入碱中和硫酸,促使平衡正向移动,提高钒的萃取率[或类似表述,如提高RAn(有机层)的浓度、百分含量等均可](2分) H2SO4(2分)
(3) NH3·H2O+V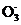
 NH4VO3↓+OH-(3分)
NH4VO3↓+OH-(3分)
(4) 氨气(或氨水)(2分) 有机萃取剂(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com