
5. 甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1) 已知在常温常压下:
①2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(g) ΔH=-1275.6kJ·mol-1
2CO2(g)+4H2O(g) ΔH=-1275.6kJ·mol-1
②H2O(l) H2O(g) ΔH=+44.0kJ·mol-1
H2O(g) ΔH=+44.0kJ·mol-1
写出表示甲醇燃烧热的热化学方程式: 。
(2) 工业上一般采用下列两种反应合成甲醇:
反应A:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
反应B:CO(g)+2H2(g) CH3OH(g) ΔH2
CH3OH(g) ΔH2
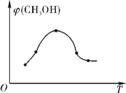
①取五份等体积的CO2和H2混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如右图所示,则上述CO2转化为甲醇反应的ΔH1 (填“>”、“=”或“<”)0。相对于反应A,反应B的优点是 。
②对于反应A,若容器容积不变,下列措施可增加甲醇产率的是 (填字母)。
A. 升高温度 B. 增加CO2的量
C. 充入He,使体系总压强增大 D. 按原比例再充入CO2和H2
③某温度下,将4molCO和12molH2充入2L密闭容器中发生反应B,达到平衡后,测得c(CO)=0.5mol·L-1,则该温度下反应的平衡常数为 。
④某种甲醇-空气燃料电池是采用铂作电极,稀硫酸作电解质溶液。该电池工作时负极的电极反应式可表示为 。
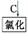
4.(2012·惠州一模)二甲基亚砜有消炎止痛、镇静等作用。甲醇和硫化氢在γ-Al2O3催化剂作用下生成甲硫醚(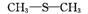 ),甲硫醚再与NO2反应制取二甲基亚砜(
),甲硫醚再与NO2反应制取二甲基亚砜(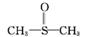 ),有关反应如下:
),有关反应如下:
反应①:2CH3OH(l)+H2S(g) (CH3)2S(l)+2H2O(l) ΔH=-akJ·mol-1
(CH3)2S(l)+2H2O(l) ΔH=-akJ·mol-1
反应②:(CH3)2S(l)+NO2(g) (CH3)2SO(l)+NO(g) ΔH=-bkJ·mol-1
(CH3)2SO(l)+NO(g) ΔH=-bkJ·mol-1
反应③:2NO(g)+O2(g) 2NO2(g) ΔH=-ckJ·mol-1
2NO2(g) ΔH=-ckJ·mol-1
(1) 写出用甲硫醚直接和氧气反应制取二甲基亚砜反应的热化学方程式: 。
(2)
能说明反应2CH3OH(l)+H2S(g) (CH3)2S(l)+2H2O(l)达平衡状态的是 (填字母)。(不考虑:2NO2
(CH3)2S(l)+2H2O(l)达平衡状态的是 (填字母)。(不考虑:2NO2 N2O4)
N2O4)
A. v(CH3OH)=2v(H2S) B. 恒容容器中,体系的压强不再改变
C. 恒容容器中,体系中气体的密度不再改变 D. 恒容容器中,NO2的深度不再改变
(3) 反应③在一定条件下可达到平衡,则此条件下该反应的平衡常数表达式为K= 。
(4) N2O5是一种新型绿色硝化剂,其制备方法有以下两种。
①方法1:4NO2(g)+O2(g) 2N2O5(g) ΔH=-56.76kJ·mol-1
2N2O5(g) ΔH=-56.76kJ·mol-1
常温下,该反应能逆向自发进行,则逆反应的ΔS (填“>”、“<”或“=”)0。
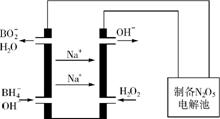
②方法2:用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如右图。则硼氢化钠燃料电池的正极反应式为 。
3.(2013·茂名二模)TiO2俗称钛白粉,用途广泛,现正广泛开发,将来有机会成为新工业。工业上利用TiO2制备金属钛的流程如下:
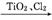
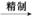 精TiCl4
精TiCl4

 金属钛
金属钛
已知:
Ti(s)+O2(g) TiO2(s) ΔH=-946kJ·mol-1
TiO2(s) ΔH=-946kJ·mol-1
2C(s)+O2(g) 2CO(g) ΔH=-221kJ·mol-1
2CO(g) ΔH=-221kJ·mol-1
Ti(s)+2Cl2(g) TiCl4(g) ΔH=-815kJ·mol-1
TiCl4(g) ΔH=-815kJ·mol-1
某温度下各物质的沸点如下:
|
物质 |
TiCl4 |
FeCl3 |
SiCl4 |
AlCl3 |
|
沸点/℃ |
136 |
310 |
56.5 |
180 |
回答下列问题:

(1)在氯化工序中发生反应:TiO2(s)+2Cl2(g)+2C(s) TiCl4(g)+2CO(g)。试计算其反应的ΔH= kJ·mol-1;该反应的平衡常数表达式为K= ,在右图中作出TiCl4达到平衡后百分含量随温度的变化趋势图。
TiCl4(g)+2CO(g)。试计算其反应的ΔH= kJ·mol-1;该反应的平衡常数表达式为K= ,在右图中作出TiCl4达到平衡后百分含量随温度的变化趋势图。
(2)氯化过程中带入的副产物有FeCl3、SiCl4和AlCl3,可用 方法获得较纯净的TiCl4。
(3)TiO2与Cl2发生反应:TiO2(s)+2Cl2(g) TiCl4(l)+O2(g) ΔH=+151kJ·mol-1。该反应在高温条件下难以发生,但加入碳后反应能顺利进行,试解析上述原因: 。
TiCl4(l)+O2(g) ΔH=+151kJ·mol-1。该反应在高温条件下难以发生,但加入碳后反应能顺利进行,试解析上述原因: 。
(4) 还原工序要在惰性气体的气氛中进行的理由是 。
2.(2013·东山二模)“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
|
实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
|
CO |
H2O |
H2 |
CO |
|||
|
1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
|
2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
|
3 |
900 |
a |
b |
c |
d |
t |
①实验1条件下平衡常数K= (取小数点后两位数字)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则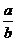 的值 (填具体值或取值范围)。
的值 (填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入10molCO、5molH2O、2molCO2、5molH2,则此时v(正) (填“<”、“>”或“=”)v(逆)。
(2)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol·L-1,则生成沉淀所需CaCl2溶液的最小浓度为 。
(3)已知:BaSO4(s)+4C(s) 4CO(g)+BaS(s) ΔH1=+571.2kJ·mol-1,
4CO(g)+BaS(s) ΔH1=+571.2kJ·mol-1,
BaSO4(s)+2C(s) 2CO2(g)+BaS(s) ΔH2=+226.2kJ·mol-1。
2CO2(g)+BaS(s) ΔH2=+226.2kJ·mol-1。
则反应C(s)+CO2(g) 2CO(g)的ΔH3= kJ·mol-1。
2CO(g)的ΔH3= kJ·mol-1。
(4)寻找新能源是解决温室效应的一条重要思路。磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池,总反应为FePO4+Li LiFePO4,电池中的固体电解质可传导Li+,则该电池放电时的正极和负极反应式分别为 和 。若用该电池电解蒸馏水(电解池电极均为惰性电极),当电解池两极共有3360mL气体(标准状况)产生时,该电池消耗锂的质量为 g。
LiFePO4,电池中的固体电解质可传导Li+,则该电池放电时的正极和负极反应式分别为 和 。若用该电池电解蒸馏水(电解池电极均为惰性电极),当电解池两极共有3360mL气体(标准状况)产生时,该电池消耗锂的质量为 g。
1. (2013·佛山二模)以下是一些物质在常压下的熔、沸点数据:
|
|
钾 |
钠 |
Na2CO3 |
金刚石 |
石墨 |
|
熔点/℃ |
63.65 |
97.8 |
851 |
3550 |
3850 |
|
沸点/℃ |
774 |
882.9 |
1850(分解产生CO2) |
—— |
4250 |
金属钠和CO2在常压、890℃下发生如下反应:
4Na(g)+3CO2(g) 2Na2CO3(l)+C(s,金刚石) ΔH=-1080.9kJ·mol-1
2Na2CO3(l)+C(s,金刚石) ΔH=-1080.9kJ·mol-1
(1)上述反应的平衡常数表达式为 ;若4v正(Na)=3v逆(CO2),反应是否达到平衡 (填“是”或“否”)。
(2)若反应在10L密闭容器、常压下进行,温度由890℃升高到1860℃,若反应时间为10min,金属钠的物质的量减少了0.2mol,则10min内CO2的平均反应速率为 。
(3)高压下有利于金刚石的制备,理由是 。
(4)由CO2(g)+4Na(g) 2Na2O(s)+C(s,金刚石) ΔH=-357.5kJ·mol-1;则Na2O固体与C(金刚石)反应得到Na(g)和液态Na2CO3(l)的热化学方程式为 。
2Na2O(s)+C(s,金刚石) ΔH=-357.5kJ·mol-1;则Na2O固体与C(金刚石)反应得到Na(g)和液态Na2CO3(l)的热化学方程式为 。
(5) 下图开关K接M时,石墨作 极,电极反应式为 。
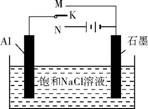

K接N一段时间后测得有0.3mol电子转移,作出n[Al(OH)3]随n(H2O)消耗变化的图像(反应物足量,标明有关数据)。
10. AB
9. AD
8. BC
7. CD
6. BD
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com