
7.
(1) ① mol·L-1·min-1
mol·L-1·min-1
②当其他条件一定时,升高温度,反应速率加快;当其他条件一定时,升高温度,平衡逆向移动
③AD
④CO2(g)+3H2(g) CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
ΔH=-130.9 kJ·mol-1
(2)
①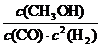 >
>
②在1.3×104 kPa下,CO的转化率已经很高,如果增加压强,CO的转化率提高不大,而生产成本增加,得不偿失
③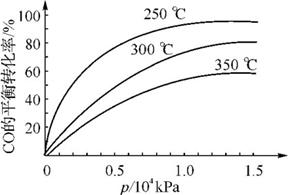
6. (1) 2.4
(2) 减小 小于
(3) D
(4) > 较高
(5)见下图

5.
(1) CH3OH(l)+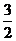 O2(g)
O2(g) CO2(g)+2H2O(l)
CO2(g)+2H2O(l)
ΔH=-725.8kJ·mol-1
(2) ①< 无副产物生成,原子利用率高 ②BD
③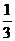 ④CH3OH+H2O-6e-
④CH3OH+H2O-6e- 6H++CO2
6H++CO2
4.
(1)2(CH3)2S(l)+O2(g) 2(CH3)2SO(l)
2(CH3)2SO(l)
ΔH=-(2b+c)kJ·mol-1
(2)BC
(3)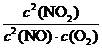
(4)①> ②H2O2+2e- 2OH-
2OH-
3.
(1) -90 

(2) 蒸馏(或分馏)
(3) 降低生成物O2的浓度,使平衡正向移动
(4) 防止高温下Na(Ti)与空气中的O2(或CO2)作用
2. (1) ①2.67 ②<1 ③<
(2) 5.6×10-5mol·L-1
(3) +172.5
(4)
FePO4+Li++e- LiFePO4 Li-e-
LiFePO4 Li-e- Li+ 1.4
Li+ 1.4
1.
(1) K=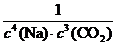 否
否
(2) 0.0015mol·L-1·min-1
(3) 增大压强加快反应速率,平衡向正反应方向移动
(4)
3Na2O(s)+C(s,金刚石) 4Na(g)+Na2CO3(l) ΔH=-4.2kJ·mol-1
4Na(g)+Na2CO3(l) ΔH=-4.2kJ·mol-1
(5)
正 O2+2H2O+4e- 4OH-
4OH-
8. 将煤气化转化成合成气,然后通过一碳化工路线合成各种油品和石化产品是一碳化工极为重要的领域,具有广阔的前景,在未来相当一段时期将成为一碳化工的主要领域。除去水蒸气后的水煤气含55%59%的H2,15%18%的CO,11%13%的CO2,少量的H2S、CH4,除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成。水煤气法制甲醇的工艺流程图如下:
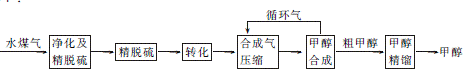
(1)
制水煤气的主要化学方程式为C(s)+H2O(g) CO(g)+H2(g),此反应是吸热反应。
CO(g)+H2(g),此反应是吸热反应。
①此反应的化学平衡常数表达式为 。
②下列能增大碳的转化率的措施是 (填字母)。
A. 加入C(s) B. 加入H2O(g) C. 升高温度 D. 增大压强
(2)
将CH4转化成CO,工业上常采用催化转化技术,其反应原理为CH4(g)+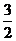 O2(g)
O2(g) CO(g)+2H2O(g) ΔH=-519kJ·mol-1。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同):
CO(g)+2H2O(g) ΔH=-519kJ·mol-1。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同):
①X在T1℃时催化效率最高,能使正反应速率加快约3×105倍
②Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍
③Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂是 (填“X”、“Y”或“Z”),选择的理由是 。
(3)
合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应如下:2H2(g)+CO(g) CH3OH(g) ΔH=-90.8kJ·mol-1,T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应进行到某时刻测得各组分的浓度如下:
CH3OH(g) ΔH=-90.8kJ·mol-1,T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应进行到某时刻测得各组分的浓度如下:
|
物 质 |
H2 |
CO |
CH3OH |
|
浓度/mol·L-1 |
0.2 |
0.1 |
0.4 |
比较此时正、逆反应速率的大小:v(正) (填“>”、“<”或“=”)v(逆)。
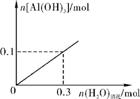
(4) 生产过程中,合成气要进行循环,其目的是 。
专题八 化学反应原理综合题型研究
7. (2012·广州天河区二模)煤的液化是把固体煤炭通过化学加工过程,使其转化成为液体燃料、化工原料和产品的先进洁净煤技术,其中合成CH3OH 是最重要的研究方向之一。
(1)
在2 L的密闭容器中,由CO2和H2合成甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g),在其他条件不变的情况下,探
CH3OH(g)+H2O(g),在其他条件不变的情况下,探

究温度对反应的影响,实验结果如右图所示(注:T2>T1,均大于300 ℃)。
①温度为T2时,从反应开始到平衡,生成甲醇的平均反应速率为 。
②通过分析右上图,温度对反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)的影响可以概括为 。
CH3OH(g)+H2O(g)的影响可以概括为 。
③下列情形能说明上述反应已达到平衡状态的是 (填字母)。
A. 体系压强保持不变
B. 密闭容器中CO2、H2、CH3OH(g)、H2O(g)4种气体共存
C. CH3OH与H2物质的量之比为1∶3
D. 每消耗1 mol CO2的同时生成3 mol H2
④已知H2(g)和CH3OH(l)的燃烧热ΔH分别为-285.8 kJ·mol-1和-726.5 kJ·mol-1,写出由CO2和H2生成液态甲醇和液态水的热化学方程式: 。
(2)
在容积可变的密闭容器中,由CO和H2合成甲醇CO(g)+2H2(g) CH3OH(g),CO在不同温度下的平衡转化率与压强的关系如右图所示。
CH3OH(g),CO在不同温度下的平衡转化率与压强的关系如右图所示。
①该反应的平衡常数表达式K= ,250 ℃、0.5×104 kPa下的平衡常数 (填“>”、“<”或“=”)300 ℃、1.5×104 kPa下的平衡常数。
②实际生产中,该反应条件控制在250 ℃、1.3×104 kPa左右,选择此压强而不选择更高压强的理由是 。
③在右图中画出350 ℃时CO的平衡转化率随压强变化的大致曲线。

6.
(2012·浙江理综)物质(t-BuNO)2在正庚烷溶剂中发生如下反应:(t-BuNO)2 2(t-BuNO)。
2(t-BuNO)。
(1) 当(t-BuNO)2的起始浓度(c0)为0.50mol·L-1时,实验测得20℃时的平衡转化率(α)是65%。列式计算20℃时上述反应的平衡常数K= 。
(2) 一定温度下,随着(t-BuNO)2的起始浓度增大,其平衡转化率 (填“增大”、“不变”或“减小”)。
已知20℃时该反应在CCl4溶剂中的平衡常数为1.9,若将反应溶剂正庚烷改成CCl4,并保持(t-BuNO)2起始浓度相同,则它在CCl4溶剂中的平衡转化率 (填“大于”、“等于”或“小于”)其在正庚烷溶剂中的平衡转化率。
(3) 实验测得该反应的ΔH=+50.5kJ·mol-1,活化能Ea=90.4kJ·mol-1。下列能量关系图合理的是 (填字母)。

(4) 该反应的ΔS (填“>”、“<”或“=”)0。在 (填“较高”或“较低”)温度下有利于该反应自发进行。

(5) 通过比色分析得到30℃时(t-BuNO)2浓度随时间的变化关系如右图所示,请在同一图中绘出t-BuNO浓度随时间的变化曲线。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com