
5. C
4. D
3. D
2. A
1. A
12. 消毒剂在生产生活中有极其重要的作用,开发具有广谱、高效、低毒的杀菌剂和消毒剂是今后发展的趋势。
(1) Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1molO3转化为1molO2和1molH2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是 (填字母)。
A. Cl2 B. H2O2 C. ClO2 D. O3
(2)
H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称。如消除采矿业废液中的氰化物(如KCN),经以下反应实现:KCN+H2O+H2O2 A+NH3↑,则生成物A的化学式为 ,H2O2被称为“绿色氧化剂”的理由是 。
A+NH3↑,则生成物A的化学式为 ,H2O2被称为“绿色氧化剂”的理由是 。
(3) 漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为HClO2——ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1molClO2生成时转移的电子数约为 。
(4) “84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是 (用离子方程式表示)。利用氯碱工业的产物可以生产“84”消毒液,写出有关反应的化学方程式: 。
专题二 氧化还原反应
3. 离子交换膜 4.冷却水
(1)
在反应3I2+6KOH 5KI+KIO3+3H2O中,氧化剂和还原剂的物质的量之比为 。
5KI+KIO3+3H2O中,氧化剂和还原剂的物质的量之比为 。
(2) 某同学查资料获知:KIO3在酸性介质中与碘化物作用生成单质碘,该反应的离子方程式为 。
(3)为确定电解是否完成,需检验阳极区电解液中是否含有I-,该同学选用淀粉溶液和稀硫酸进行实验,其他仪器及用品自选,请完成其方案:
|
实验操作 |
现象及结论 |
|
|
|
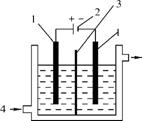
1. 惰性电极 2. 直流电源
11.
(2013·惠州三调改编)碘酸钾(KIO3)晶体是我国规定的食盐加碘剂。它通常是以碘为原料与过量KOH溶液通过下列反应制得:3I2+6KOH 5KI+KIO3+3H2O,再将KI和KIO3的混合溶液电解,将其中的I-转化为I
5KI+KIO3+3H2O,再将KI和KIO3的混合溶液电解,将其中的I-转化为I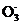 ,装置如右图。
,装置如右图。
10. (2013·汕头东山中学月考)已知:
Ⅰ. NaBiO3是微溶于水的黄色固体。
Ⅱ. 实验室可用KMnO4和盐酸反应制Cl2,化学方程式为
2KMnO4+16HCl 2KCl+2MnCl2+5Cl2↑+8H2O。
2KCl+2MnCl2+5Cl2↑+8H2O。
(1) 将NaBiO3固体加入到MnSO4和H2SO4的混合溶液中加热,发生反应的化学方程式为 NaBiO3+ MnSO4+ H2SO4—— Na2SO4+ Bi2(SO4)3+ NaMnO4+ H2O
请配平该化学方程式。
(2) 上述反应中氧化剂是 (填化学式),被氧化的元素是 (填元素符号)。
(3)
若有2mol氧化剂在上述反应中被还原,则生成的Mn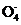 被还原为Mn2+时,能将 molHCl氧化成Cl2。
被还原为Mn2+时,能将 molHCl氧化成Cl2。
(4) 写出NaBiO3固体溶于盐酸时发生反应的离子方程式: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com