
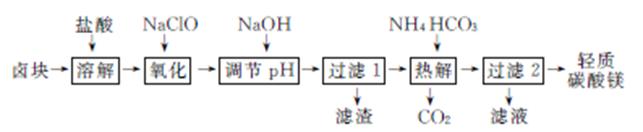
3. (2013·六校模拟)轻质碳酸镁是广泛应用于橡胶、塑料、食品和医药工业的化工产品,以卤块(主要成分为MgCl2,含Fe2+、Fe3+、Mn2+等杂质离子)为原料制备轻质碳酸镁[MgCO3·Mg(OH)2·3H2O]的工艺流程如下:
|
物质 |
开始沉淀 |
沉淀完全 |
|
Fe(OH)3 |
2.7 |
3.7 |
|
Fe(OH)2 |
7.6 |
9.6 |
|
Mn(OH)2 |
8.3 |
9.8 |
|
Mg(OH)2 |
9.9 |
11.1 |
已知生成氢氧化物沉淀的pH如右上表。
(1) “氧化”一步中发生反应的离子方程式为 。
(2) “调节pH”一步应调节溶液的pH=9.8,能除去的杂质是 。
(3) “热解”一步温度控制在75℃左右,其原因是 。
写出此反应的离子方程式: 。
(4) 从“过滤2”步骤中得到的滤液中能回收的盐类物质主要有 (填化学式)。
(5) 取1.96g轻质碳酸镁于锥形瓶中,用同一浓度的盐酸进行滴定反应,数据如下:
|
实验序号 |
轻质碳酸镁用量/g |
盐酸开始读数/mL |
盐酸终止读数/mL |
|
1 |
1.96 |
1.00 |
11.01 |
|
2 |
1.96 |
11.10 |
22.03 |
|
3 |
1.96 |
22.10 |
32.09 |
依据上述实验数据,算出盐酸的物质的量浓度为 (结果保留三位有效数字)。
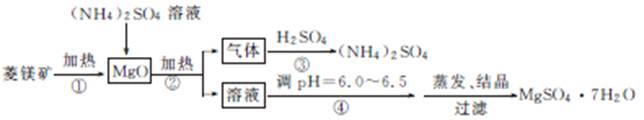
2. (2013·南海模拟)菱镁矿是碱性耐火材料的主要原料,其主要的化学成分是MgCO3,同时含有杂质:SiO2、Al2O3、Fe2O3、CaO等;目前以菱镁矿为主要原料制备MgSO4的方法如下:
|
|
Fe3+ |
Al3+ |
Mg2+ |
|
开始沉淀 |
2.1 |
3.7 |
9.0 |
|
沉淀完全 |
3.2 |
5.2 |
12.4 |
已知:①常温下,Fe3+、A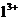 、Mg2+开始形成氢氧化物沉淀和沉淀完全时的pH如上表。
、Mg2+开始形成氢氧化物沉淀和沉淀完全时的pH如上表。
②MgSO4·7H2O在7080℃时失去3个结晶水,300℃时失去全部的结晶水。
(1) 用平衡原理解释菱镁矿粉粹后加热生成的氧化镁可以溶解在硫酸铵溶液中的原因:
。
(2) 在该工业流程中,可以循环使用的物质是 。
(3) 步骤③中氨气和硫酸恰好完全反应,取此时所得的溶液10.00mL配成250mL溶液,配制溶液过程中除烧杯、玻璃棒、胶头滴管、酸式滴定管外,还需要的玻璃仪器有 ;经检测所配制的溶液pH=1,c(S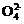 )=1.05mol·L-1,试求算所配制溶液中N
)=1.05mol·L-1,试求算所配制溶液中N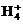 水解的平衡常数K(写出计算过程,计算结果保留三位有效数字)。
水解的平衡常数K(写出计算过程,计算结果保留三位有效数字)。
(4) 在加热条件下杂质中的三氧化二铁溶于硫酸铵的离子方程式为 。
(5) 蒸发结晶过程中需要使用6070℃水浴加热的方式,其原因是 。
1. (2013·中山最后一模)镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O。
③Ksp[Ni(OH)2]=5.0×10-16,Ksp(NiC2O4)=4.0×10-10。
回答下列问题:
(1) 酸溶后所留残渣的主要成分为 (填物质名称)。
(2) 用NiO调节溶液的pH,析出沉淀的成分为 (填化学式)。
(3) 写出加入Na2C2O4溶液后反应的化学方程式: 。
(4) 写出加入NaOH溶液所发生反应的离子方程式: ,
该反应的平衡常数为 。
(5) 沉淀Ⅲ可被电解所得产物之一氧化,写出氧化反应的离子方程式: 。
(6) 如何检验Ni(OH)3已洗涤干净? 。
12. (1) C
(2) KHCO3 H2O2的还原产物是H2O,没有污染
(3) 6.02×1023
(4) ClO-+Cl-+2H+ Cl2↑+H2O
Cl2↑+H2O
Cl2+2NaOH NaClO+NaCl+H2O
NaClO+NaCl+H2O
11. (1) 5∶1
(2) I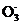 +5I-+6H+
+5I-+6H+ 3I2+3H2O
3I2+3H2O
(3)
|
实验操作 |
现象及结论 |
|
取少量阳极区的电解液于试管中,加入少量稀硫酸酸化,再加入几滴淀粉溶液 |
若溶液不变蓝,说明没有I-;若溶液变蓝,说明有I- |
10. (1) 10 4 14 3 5 4 14
(2) NaBiO3 Mn
(3) 4
(4) NaBiO3+6H++2Cl- Na++Bi3++Cl2↑+3H2O
Na++Bi3++Cl2↑+3H2O
9. (1) C
(2) C+H2O(g) CO+H2 氧化
CO+H2 氧化
(3) ①4 2 3 1 1 4 ②氮 CuO ③1.2
8. AD
7. AC
6. D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com