
4. (1) KCl、NH3
(2) CaSO4·2H2O+C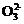
 CaCO3+S
CaCO3+S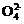 +2H2O
+2H2O
(3) 取少量滤液于试管中,滴加盐酸,若产生气泡,证明滤液中含有C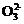
(4) CaO+2NH4Cl+5H2O CaCl2·6H2O+2NH3↑
CaCl2·6H2O+2NH3↑
(5) ad
3. (1) ClO-+2H++2Fe2+ 2Fe3++Cl-+H2O
2Fe3++Cl-+H2O
(2) Fe3+、Mn2+
(3) 温度太低,反应速率慢;温度太高,NH4HCO3会分解 2Mg2++4HC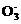 +2H2O
+2H2O MgCO3·Mg(OH)2·3H2O↓+3CO2↑
MgCO3·Mg(OH)2·3H2O↓+3CO2↑
(4) NaCl、NH4Cl
(5) 4.00mol·L-1
2.10-0.10 0.10 0.10
c=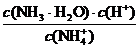 =
=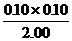 =5.00×10-3
=5.00×10-3
(4) Fe2O3+6N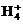
 6NH3↑+2Fe3++3H2O
6NH3↑+2Fe3++3H2O
(5) 避免加热蒸发过程中MgSO4·7H2O失去部分或全部的结晶水
2.10 0 0
c(平衡)/mol·L-1
2. (1) 因N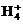 +H2O
+H2O NH3·H2O+H+,MgO+2H+
NH3·H2O+H+,MgO+2H+ Mg2++H2O,氧化镁消耗氢离子,铵根离子水解平衡向右移动,不断提供H+使MgO不断溶解
Mg2++H2O,氧化镁消耗氢离子,铵根离子水解平衡向右移动,不断提供H+使MgO不断溶解
(2) (NH4)2SO4
(3) 250mL容量瓶
由题意可知,因c(S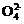 )=1.05mol·L-1,则配制得到的c[(NH4)2SO4]=1.05mol·L-1,所以不考虑水解时c(N
)=1.05mol·L-1,则配制得到的c[(NH4)2SO4]=1.05mol·L-1,所以不考虑水解时c(N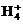 )=2.10mol·L-1,溶液中c(H+)=0.10mol·L-1≈c(NH3·H2O)。则
)=2.10mol·L-1,溶液中c(H+)=0.10mol·L-1≈c(NH3·H2O)。则
N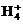 +H2O
+H2O NH3·H2O+H+
NH3·H2O+H+
c(开始)/mol·L-1
1. (1) 碳粉 (2) Fe(OH)3、Al(OH)3
(3) NiCl2+Na2C2O4+2H2O NiC2O4·2H2O↓+2NaCl
NiC2O4·2H2O↓+2NaCl
(4) NiC2O4·2H2O+2OH- Ni(OH)2+C2
Ni(OH)2+C2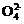 +2H2O 8.0×105
+2H2O 8.0×105
(5) 2Ni(OH)2+2OH-+Cl2 2Ni(OH)3+2Cl-
2Ni(OH)3+2Cl-
(6) 取少量最后一次洗涤液于试管中,加入少量AgNO3溶液,若无白色沉淀生成,证明沉淀已洗涤干净
7. (2012·江门模拟)无水AlCl3易升华,可用作有机合成的催化剂等。工业上由铝土矿(Al2O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下:
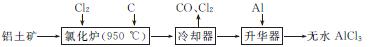
(1) 氯化炉中Al2O3、Cl2和C反应的化学方程式为 。
(2) 用Na2SO3溶液可除去冷却器排出尾气中的Cl2,此反应的离子方程式为 。在标准状况下,吸收112 L Cl2需要 mol Na2SO3。
(3) 为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,经洗涤、灼烧、冷却、称重。试写出测定无水AlCl3产品纯度的过程中有关反应的离子方程式: 、 。
(4) 工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3·6H2O脱去结晶水制备无水AlCl3,实现这一步的操作方法是 。
(5) 工业上铝土矿经提纯后可冶炼铝,写出在950970 ℃和Na3AlF6作用下进行电解制铝反应的化学方程式: 。
第三篇 化学工艺流程
AA9
专题九 物质的制备与化学工艺流程综合题型研究
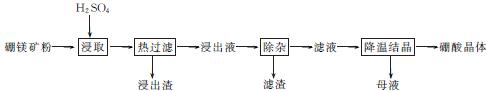
6. (2013·广州二模)硼酸(H3BO3)大量应用于玻璃制造行业,以硼镁矿(2MgO·B2O3·H2O、SiO2及少量Fe3O4、CaCO3、Al2O3)为原料生产硼酸的工艺流程如下:
已知:H3BO3在20℃、40℃、60℃、100℃时的溶解度依次为5.0g、8.7g、14.8g、40.2g。Fe3+、A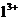 、Fe2+和M
、Fe2+和M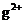 以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4。
以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4。
(1) 由于矿粉中含CaCO3,“浸取”时容易产生大量泡沫使物料从反应器中溢出,故应分批加入稀硫酸。该反应的化学方程式为 。
(2) “浸出液”显酸性,含H3BO3和Mg2+、S ,还含有Fe3+、Fe2+、Ca2+、Al3+等杂质。“除杂”时向浸出液中依次加入适量H2O2和MgO,除去的杂质离子是 。H2O2的作用是 (用离子方程式表示)。
,还含有Fe3+、Fe2+、Ca2+、Al3+等杂质。“除杂”时向浸出液中依次加入适量H2O2和MgO,除去的杂质离子是 。H2O2的作用是 (用离子方程式表示)。
(3) “浸取”后,采用“热过滤”的目的是 。
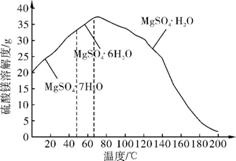
(4) “母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如右图,且溶液的沸点随压强增大而升高。为了从“母液”中充分回收MgSO4·H2O,应采取的措施是将“母液”蒸发浓缩、 。
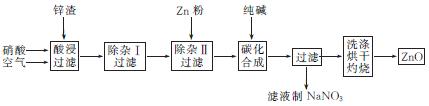
5. (2013·珠海一模)现从锌制品加工企业回收的废渣(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质)来制取氧化锌,流程如下:
有关氢氧化物完全沉淀的pH见下表:
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
|
pH |
5.2 |
3.2 |
9.7 |
6.7 |
8.0 |
(1) 在酸浸过程中,要提高浸出率,可以采取 措施(任写一种)。
(2) 上述流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有 。
(3) 在“除杂Ⅰ”步骤中,将溶液调至pH=4的目的是 。在“除杂Ⅱ”后,溶液的pH约为6,则此步过滤时滤渣中含有 。
(4) 在“碳化合成”中,生成的产物之一为碱式碳酸锌[Zn2(OH)2CO3],同时放出CO2,请写出该反应的化学方程式: 。
(5) 从滤液中提取NaNO3晶体的操作步骤为 。
(6) 在实验室如何洗涤过滤出的碱式碳酸锌? 。
4. (2013·中山一模改编)将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。下图是石膏转化为硫酸钾和氯化钙的工艺流程示意图。
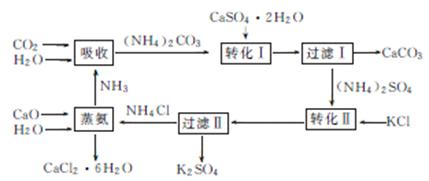
(1) 本工艺中所用的原料除CaSO4·2H2O、CaCO3、H2O外,还需要 等原料。
(2) 写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式: 。
(3) 过滤Ⅰ操作所得滤液是(NH4)2SO4溶液。检验滤液中含有C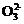 的操作方法是
的操作方法是
。
(4) 写出蒸氨过程中的化学方程式: 。
(5) 氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是 (填字母)。
a. 熔点较低(29℃熔化) b. 能导电 c. 能制冷 d. 无毒
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com