
7. (2013·中山一模)碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是理想,更是一种值得期待的新的生活方式,请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1) 近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式如下:
C+ K2Cr2O7+ —— CO2↑+ K2SO4+ Cr2(SO4)3+ H2O
请完成并配平上述化学方程式。
其中氧化剂是 ,氧化产物是 。
(2) 甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式如下:
CO(g)+2H2(g) CH3OH(g) ΔH1=-116kJ·mol-1
CH3OH(g) ΔH1=-116kJ·mol-1
①已知:CO(g)+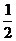 O2(g)
O2(g) CO2(g) ΔH2=-283kJ·mol-1
CO2(g) ΔH2=-283kJ·mol-1
H2(g)+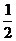 O2(g)
O2(g) H2O(g) ΔH3=-242kJ·mol-1
H2O(g) ΔH3=-242kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气的热化学方程式为
。
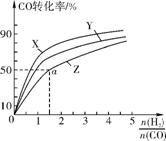
②在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律。右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。
请回答下列问题:
ⅰ)在上述三种温度中,曲线Z对应的温度是 。
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下化学反应的平衡常数K= 。
③在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的量浓度(单位:mol·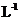 )变化如下表所示:
)变化如下表所示:
|
|
0min |
5min |
10min |
|
CO |
0.1 |
|
0.05 |
|
H2 |
0.2 |
|
0.2 |
|
CH3OH |
0 |
0.04 |
0.05 |
若510min只改变了某一条件,所改变的条件是 ;且该条件所改变的量是 。
6. (2013·肇庆一模)甲醇被称为21世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇:
Ⅰ. CH4(g)+H2O(g) CO(g)+3H2(g) Ⅱ. CO(g)+2H2(g)
CO(g)+3H2(g) Ⅱ. CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
(1) 将1.0molCH4和2.0molH2O(g)通入容积为100L的反应室,在一定条件下发生反应Ⅰ,CH4的平衡转化率与温度、压强的关系如右下图。
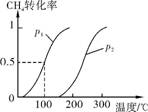
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为 。
②图中的p1 (填“<”、“>”或“=”)p2,100℃时平衡常数的值为 。
(2) 在压强为0.1MPa条件下,将amolCO与3amolH2的混合气体在催化剂作用下,自发进行反应Ⅱ,生成甲醇。
③该反应的ΔH (填“<”、“>”或“=”)0;若容器容积不变,下列措施可增加甲醇产率的是 (填字母)。
A. 升高温度 B. 将CH3OH(g)从体系中分离
C. 充入He,使体系总压强增大 D. 再充入1molCO和3molH2
④为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
|
实验编号 |
T/℃ |
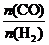 |
p/MPa |
|
i |
150 |
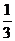 |
0.1 |
|
ii |
|
|
5 |
|
iii |
350 |
|
5 |
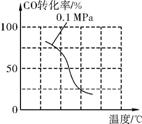
a. 请在上表空格中填入剩余的实验条件数据。
b. 根据反应Ⅱ的特点,在给出的坐标图中,补画出在5MPa条件下CO的转化率随温度变化的趋势曲线示意图,并标明压强。
5. (2013·增城一模改编)尿素在农业生产中起重要作用,其合成过程分两步进行:
2NH3(g)+CO2(g) NH2COONH4(l) ΔH=-117kJ·mol-1
NH2COONH4(l) ΔH=-117kJ·mol-1
NH2COONH4(l) (NH2)2CO(g)+H2O(g) ΔH=+15kJ·mol-1
(NH2)2CO(g)+H2O(g) ΔH=+15kJ·mol-1
(1) 对于第一步反应,能判断该反应一定达到化学平衡状态的依据是 (填字母)。
A. 容器中气体的平均相对分子质量不随时间而变化
B. v正(NH3)=2v逆(CO2)
C. 容器中气体的密度不随时间而变化
D. 容器中总质量不随时间而变化
(2) 第一步反应生成了1mol氨基甲酸铵,再发生第二步反应时的转化率与温度、压强的关系如下:
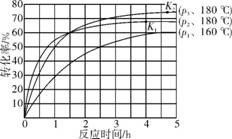
①在180℃的条件下,p2 p3;化学平衡常数K1 K2。(填“>”、“<”或“=”)
②在某体积为2L的密闭容器中,利用图中的数据,求160℃时该反应的平衡常数K。
4.
(2013·汕头一模)在一密闭容器中发生反应:2A(g)+B(g) E(g)。
E(g)。
(1) 写出该反应的平衡常数表达式: ,已知升高温度时,v(正)>v(逆),此时K值 (填“变大”、“变小”或“不变”);该反应的ΔH (填“>”、“=”或“<”)0。
(2) 将1.0molA和1.0molB混合后装入2L容器中发生反应,E的物质的量的变化如右下图所示。
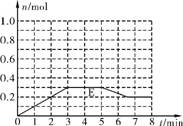
①3min内E的平均反应速率为 。
②此温度下该反应的平衡常数K为 (结果保留小数点后1位)。
③请在图中画出5min内A的物质的量的变化曲线。
(3) 已知在如图所示的变化中,平衡常数K保持不变,则在57min内引起E的物质的量变化的原因可能是 (填序号)。
①降低了温度 ②升高了温度 ③使用了催化剂 ④增大了容器的体积 ⑤缩小了容器的体积 ⑥减少了A的物质的量
3.
(2013·江门一模改编)在一定条件下,NO与NO2混合可生成N2O3,反应的化学方程式为NO(g)+NO2(g) N2O3(l) ΔH<0。
N2O3(l) ΔH<0。
右下图表示一定量的NO、NO2混合气体发生反应时,c(NO2)在前25s内的变化。该反应进行到45s时达到平衡,测得c(NO2)约为0.010mol·L-1。
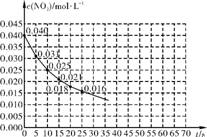
(1) 前20s内,NO2的平均反应速率为 。
(2) 其他条件不变,①升高温度,NO2的转化率 (填“增大”、“减小”或“不变”)。②压缩气体体积,该反应平衡向 (填“正向”或“逆向”)移动。
(3) 若反应延续至70s,请在图中画出2570s的反应进程曲线。
(4) 若在反应开始时加入催化剂(其他条件都不变),请在图中画出加催化剂后的反应进程曲线。
2.
(2013·广州一模改编)氨是最重要的化工产品之一。用氨气制取尿素[CO(NH2)2]的反应为2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)。
CO(NH2)2(l)+H2O(g)。
(1)某温度下,向容积为10L的密闭容器中通入2molNH3和1molCO2,反应达到平衡时CO2的转化率为50%。该反应的化学平衡常数表达式为K= 。该温度下平衡常数K的计算结果为 。
(2)为进一步提高CO2的平衡转化率,下列措施能达到目的的是 (填字母)。
A. 提高NH3的浓度
B. 增大压强
C. 及时转移生成的尿素
D. 使用更高效的催化剂
1.
(2013·汕头金山中学期末)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
|
T/℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1) 该反应的化学平衡常数表达式为K= 。
(2) 该反应为 (填“吸热”或“放热”)反应。
(3) 下列能判断该反应是否达到化学平衡状态的依据是 (填字母)。
a. 容器中压强不变 b. 混合气体中c(CO)不变
c. v正(H2)=v逆(H2O) d. c(CO2)=c(CO)
(4) 某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
7. (1) Al2O3+3Cl2+3C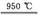 2AlCl3+3CO
2AlCl3+3CO
(2) S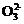 +Cl2+H2O
+Cl2+H2O S
S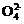 +2Cl-+2H+ 5
+2Cl-+2H+ 5
(3) Fe3++3OH- Fe(OH)3↓ Al3++4OH-
Fe(OH)3↓ Al3++4OH- Al
Al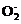 +2H2O (4)
在干燥的HCl气流中加热
+2H2O (4)
在干燥的HCl气流中加热
(5) 2Al2O3(熔融) 4Al+3O2↑
4Al+3O2↑
6. (1) CaCO3(粉末)+H2SO4 CaSO4+H2O+CO2↑
CaSO4+H2O+CO2↑
(2) Fe3+、Fe2+、Al3+
H2O2+2H++2Fe2+ 2Fe3++2H2O
2Fe3++2H2O
(3) 防止温度下降时H3BO3从溶液中析出
(4) 加压升温结晶
5. (1) 适当提高反应液的温度、充分搅拌或适当增加酸的浓度等(任写一种)
(2) 烧杯、玻璃棒、漏斗
(3) 使Fe3+转化为Fe(OH)3沉淀除去 Al(OH)3、Cu、Zn
(4) 2Na2CO3+2Zn(NO3)2+H2O 4NaNO3+Zn2(OH)2CO3+CO2↑
4NaNO3+Zn2(OH)2CO3+CO2↑
(5) 蒸发浓缩、冷却结晶、过滤
(6) 往漏斗中加入少量蒸馏水,浸没沉淀,让其自然滤出,重复操作23次
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com