
4. A
3. C
2. A
1. C
14. (2012·广州二模改编)
(1) 某温度下,将0.10molCH3COOH溶于水配成1L溶液。
①实验测得已电离的醋酸分子占原有醋酸分子总数的1.3%,求该温度下CH3COOH的电离平衡常数K。(水的电离忽略不计,醋酸电离对醋酸分子浓度的影响忽略不计)
②向该溶液中再加入 molCH3COONa可使溶液的pH约为4。(溶液体积变化忽略不计)
(2) ①通常情况下,AgBr呈浅黄色,见光变 色。现向AgBr的悬浊液中,加入更多的AgBr固体,则c(Ag+) (填“变大”、“变小”或“不变”)。
②下列有关难溶盐的溶度积常数及溶解度的叙述正确的是 (填字母,下同)。
A. 将难溶电解质放入纯水中,溶解达到平衡时,升温Ksp一定增大
B. 两种难溶盐电解质,其中Ksp小的溶解度也一定小
C. 难溶盐电解质的Ksp与温度有关
D. 在一定温度下,向AgCl的悬浊液中加入适量的水,使AgCl再次达到溶解平衡,AgCl的Ksp不变,其溶解度也不变
③已知25℃时,几种物质的溶度积常数为AgCl:1.8×10-10;AgBr:7.7×10-13,AgI:8.51×10-16,下列有关说法错误的是 。
A. 三种物质在常温下溶解度最小的是AgI
B. 饱和AgCl溶液中,c(Ag+)≈1.34×10-5mol·L-1
C. 将氯化银置于饱和KI溶液中,固体慢慢会由白色转变为黄色
D. 将浓度均为1×10-6mol·L-1的AgNO3溶液、KBr溶液等体积混合会生成沉淀
专题七 电解质溶液中的离子平衡
13.
已知NaHSO4在水中的电离方程式为NaHSO4 Na++H++S
Na++H++S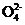 。运用相关原理,回答下列各小题:
。运用相关原理,回答下列各小题:
(1) 常温下,pH=5的NaHSO4溶液中水的电离程度 (填“>”、“=”或“<”)pH=9的氨水中水的电离程度。
(2)
等体积等物质的量浓度的NaHSO4与氨水混合后,溶液呈酸性的原因是 (用离子方程式表示);若一定量的NaHSO4溶液与氨水混合后溶液的pH=7,则c(Na+)+c(N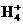 ) (填“>”、“<”或“=”,下同)2c(S
) (填“>”、“<”或“=”,下同)2c(S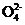 );用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中S
);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中S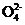 完全沉淀,则反应后溶液的pH 7。
完全沉淀,则反应后溶液的pH 7。
(3)
将分别含有Mn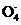 、Fe3+、Fe2+、I-的四种溶液混合,调节溶液的pH=1,充分反应后:
、Fe3+、Fe2+、I-的四种溶液混合,调节溶液的pH=1,充分反应后:
①若I-有剩余,上述四种离子在溶液中还存在的有 ,一定不存在的有 。
②若所得混合液呈紫色,上述四种离子在溶液中一定存在的有 ,一定不存在的有 。
12. (2013·广州一模节选)亚磷酸(H3PO3)是二元酸,与足量NaOH溶液反应生成Na2HPO3。
(1)
PCl3水解可制取亚磷酸:PCl3+3H2O H3PO3+ 。
H3PO3+ 。
(2)
H3PO3溶液中存在电离平衡:H3PO3 H++H2P
H++H2P 。
。
①某温度下,0.10mol·L-1H3PO3溶液的pH=1.6,即溶液中c(H+)=2.5×10-2mol·L-1。求该温度下上述电离平衡的平衡常数K(写出计算过程)。(H3PO3的第二步电离忽略不计,结果保留两位有效数字)
②根据H3PO3的性质可推测Na2HPO3稀溶液的pH (填“>”、“=”或“<”)7。
(3) 亚磷酸具有强还原性,可使碘水褪色。该反应的化学方程式为 。
三、 非选择题
11.
(2013·广州二模节选)工业上可用Na2SO3溶液吸收烟气中的SO2:Na2SO3+SO2+H2O 2NaHSO3。某温度下用1.0mol·L-1Na2SO3溶液吸收纯净的SO2,当溶液中c(S
2NaHSO3。某温度下用1.0mol·L-1Na2SO3溶液吸收纯净的SO2,当溶液中c(S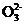 )降至0.2mol·L-1时,吸收能力显著下降,应更换吸收剂。
)降至0.2mol·L-1时,吸收能力显著下降,应更换吸收剂。
(1)
此时溶液中c(HS )约为 mol·L-1;
)约为 mol·L-1;
(2)
此时溶液的pH= 。(已知该温度下S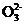 +H+
+H+ HS
HS 的平衡常数K=8.0×106,计算时SO2、H2SO3的浓度忽略不计)
的平衡常数K=8.0×106,计算时SO2、H2SO3的浓度忽略不计)
10. (2013·惠州期初)下列关于电解质溶液的叙述正确的是( )
A. 常温下,Na2CO3溶液的pH>7
B. 0.1mol·L-1Na2CO3溶液在35℃时碱性比25℃强,说明该水解反应是放热反应
C. 常温下,pH=7的NH4Cl与氨水的混合溶液中各离子浓度的关系:
c(Cl-)=c(N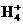 )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
D. 常温下,中和pH与体积均相同的盐酸和醋酸,消耗NaOH的物质的量相同
9. (2013·广东十校联考)下列各溶液中,微粒的物质的量浓度关系正确的是( )
A. 常温下,将pH=2的盐酸和pH=12的氨水等体积混合后:c(N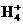 )>c(Cl-)>
c(OH-)>c(H+)
)>c(Cl-)>
c(OH-)>c(H+)
B. 0.1mol·L-1 Na2CO3溶液:c(Na+)=2c(HC )+2c(C
)+2c(C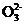 )+2c(H2CO3)
)+2c(H2CO3)
C. 0.1mol·L-1
NH4Cl溶液:c(N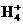 )=c(
Cl-)
)=c(
Cl-)
D. 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com