
12. (2013·湛江二模)元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是( )
A. 若X+和Y2-的核外电子层结构相同,则原子序数:X>Y
B. 由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S
C. 硅、锗都位于金属与非金属的交界处,都可以作半导体材料
D. Cs和Ba分别位于第6周期ⅠA和ⅡA族,碱性:CsOH<Ba(OH)2
11. (2013·百校大联考)短周期主族元素X、Y、Z、W的原子序数依次增大。X的最外层电子数是次外层的2倍,Y原子半径是同周期元素中最大的,Z的M层电子数是K层电子数的3倍,Y、Z最外层电子数之和与W的最外层电子数相等。下列叙述正确的是( )
A. 元素Y与元素W的最高正化合价之和的数值等于8
B. 原子半径:W>Z
C. 元素W的简单气态氢化物的热稳定性比Z的强
D. 化合物Y2X2、XZ2、X2W2化学键类型完全相同
10. (2013·韶关二模改编)下图为元素周期表中短周期的一部分,下列说法正确的是( )
|
① |
② |
③ |
|
④ |
⑤ |
⑥ |
A. ①⑥可能全部是非金属元素
B. 对应单质的非金属性:②>③
C. ④的最高价氧化物对应水化物可能为两性物质
D. ②、⑤的最高价氧化物对应水化物一定为强酸
二、 双项选择题
9. (2012·湛江一模改编)下表为元素周期表前三周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述正确的是( )
|
X |
|
|
W |
|
|
Y |
Z |
R |
A. X离子的还原性强于W离子的还原性
B. W元素的最高价氧化物对应水化物的酸性最强
C. Y的气态氢化物比Z的气态氢化物的稳定性差
D. Y、Z和W的阴离子半径依次增大
8. (2013·珠海期初)短周期元素W、X、Y、Z在元素周期表中的位置如下图所示,下列说法正确的是( )

A. Y的原子半径在同周期主族元素中最大
B. W的最高价氧化物对应水化物是强酸
C. W的非金属性比Z的弱
D. Z的氢化物溶于水溶液呈弱碱性
7. (2013·广州三模)下图是部分短周期元素原子半径与原子序数的关系图。下列说法正确的是( )
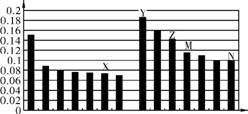
A. Z、N两种元素的离子半径相比,前者较大
B. X、N两种元素的气态氢化物的稳定性相比,前者较弱
C. 由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D. Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液
6. (2013·广州期末)短周期元素甲、乙、丙、丁、戊的原子序数依次增大,甲是周期表中原子半径最小的元素,乙形成的气态氢化物的水溶液呈碱性,乙与丁同族,丙、丁、戊同周期,丙单质可制成半导体材料,戊的最高正价为+7价。下列说法正确的是( )
A. 原子半径:乙>丁>丙
B. 非金属性:丙>丁>戊
C. 甲与戊形成的化合物是共价化合物
D. 乙、丙、丁最高价氧化物对应水化物均是强酸
5. (2013·中山一模)X、Y、Z、W均为短周期元素,在元素周期表中的相对位置如下图,Y原子的最外层电子数是其次外层电子数的3倍。下列说法正确的是( )
|
X |
Y |
|
|
|
Z |
W |
A. 原子半径:X>Y>Z>W
B. X、W的气态氢化物能相互反应,生成共价化合物
C. Z、W的最高价氧化物对应水化物的酸性,前者更强
D. Y的单质与氢气反应较Z剧烈
4.
(2012·浙江高考)X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质。已知:甲+乙 丁+己,甲+丙
丁+己,甲+丙 戊+己;0.1
mol·L-1丁溶液的pH为13(25 ℃)。下列说法正确的是( )
戊+己;0.1
mol·L-1丁溶液的pH为13(25 ℃)。下列说法正确的是( )
A. 原子半径:W>Z>Y>X
B. Y元素在周期表中的位置为第3周期ⅣA族
C. 1 mol甲与足量的乙完全反应共转移1 mol电子
D. 1.0 L 0.1 mol·L-1戊溶液中阴离子总的物质的量小于0.1 mol
3. (2013·惠州一模)X、Y、Z是位于同一周期的三种短周期元素,它们的最高价氧化物对应水化物分别为HXO4、H2YO4、H3ZO4。下列判断错误的是( )
A. 原子半径:X>Y>Z
B. 非金属性:X>Y>Z
C. 气态氢化物稳定性:X>Y>Z
D. 酸性:HXO4>H2YO4>H3ZO4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com