
2.(2013·佛山一模节选)为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究:
[查阅资料]2KNO3 2KNO2↑+O2↑ Fe(NO3)2
2KNO2↑+O2↑ Fe(NO3)2 FexOy+NO2↑+O2↑
FexOy+NO2↑+O2↑
[实验内容]探究Fe(NO3)2热分解固体产物中Fe元素的价态。该小组甲同学将分解后的固体产物溶于足量的稀硫酸得到相应两份溶液,进行以下探究实验。
(1) [提出猜想]
猜想一:Fe元素只显+2价;
猜想二:Fe元素 ;
猜想三:Fe元素既有+2价又有+3价。
(2) [实验操作]①向一份溶液中滴入KSCN溶液;②向另一份溶液中滴入酸性KMnO4稀溶液。
[实验现象]若猜想二成立,则实验①: ;实验②: 。
(3) [实验结论]猜想二成立,则Fe(NO3)2分解的化学方程式是 。
[问题思考]提示
1.(2013·潮州一模节选)NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+ Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况。此消毒液中NaClO可吸收空气中的CO2生成NaHCO3和HClO而变质,写出该反应的化学方程式: 。
Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况。此消毒液中NaClO可吸收空气中的CO2生成NaHCO3和HClO而变质,写出该反应的化学方程式: 。
4. (2013·梅州一模节选)工业上用重晶石(BaSO4)制备BaCO3的常用方法主要有高温锻烧还原法、沉淀转化法等。高温煅烧还原法的工艺流程可简单的表示如下:
重晶石矿粉 BaS等
BaS等 溶液
溶液 BaCO3
BaCO3
(1) 若“煅烧”时产生一种有毒的还原性气体,则反应的化学方程式为 。
(2) 工业上煅烧重晶石矿粉时,为使BaSO4得到充分的还原和维持反应所需的高温,应采取的措施是 (填字母)。
a. 加入过量的炭,同时通入空气 b. 设法将生成的BaS及时移出

|
1. 已知氧化性强弱:Cl2>Br2>Fe3+>I2>S;还原性强弱:S2->I->Fe2+>Br->Cl-。则FeBr2溶液中通入少量氯气、足量氯气和等物质的量的氯气所发生反应的离子方程式怎么书写 |
|
2. 若将上述FeBr2溶液改成FeI2溶液,这三种情况又是怎样 |
|
|

课堂评价
3. (2013·惠州一调节选)某同学拟用粗氧化铜(含少量FeO及不溶于酸的杂质)制取无水氯化铜,流程如下图:
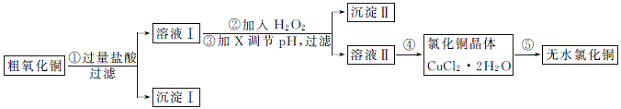
(1) 步骤①中氧化铜与盐酸反应的离子方程式为 。
(2) 步骤②中加入H2O2的目的是 ,沉淀Ⅱ的化学式为 。
2. (2013·深圳二模)下列说法不正确的是( )
A. 用排水法收集NO可以除去其中少量的NO2
B. 工业氨氧化法制HNO3,每一步都涉及氧化还原反应
C. 用NaOH溶液除去Cl2中含有的少量HCl
D. 向含硫燃煤中添加适量CaO可以减少SO2的排放
1. (2013·广州一模)下列陈述Ⅰ、Ⅱ正确并且有因果关系的是( )
|
选项 |
陈述Ⅰ |
陈述Ⅱ |
|
A |
浓硫酸有吸水性 |
浓硫酸可用于干燥NH3 |
|
B |
SO2有氧化性 |
SO2尾气可用NaOH溶液吸收 |
|
C |
Mg有还原性 |
电解MgCl2饱和溶液可制备Mg |
|
D |
锌金属性比铁强 |
海轮外壳上装锌块可减缓腐蚀 |
4. (2010·广东高考第32题节选)某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其进行吸收处理。反应Cl2+Na2SO3+2NaOH 2NaCl+Na2SO4+H2O中的还原剂为 。
2NaCl+Na2SO4+H2O中的还原剂为 。
3. (2011·广东高考第32题节选)由熔盐电解法获得的粗铝含有一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝。工艺流程如下:

注:NaCl熔点为801℃;AlCl3在181℃升华。
(1) 精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质。相关的化学方程式为① 和② 。
(2) 在用废碱液处理A的过程中,所发生反应的离子方程式为 。
2. (2012·广东高考第10题)下列应用不涉及氧化还原反应的是( )
A. Na2O2用作呼吸面具的供氧剂 B. 工业上电解熔融状态Al2O3制备Al
C. 工业上利用合成氨实现人工固氮 D. 实验室用NH4Cl和Ca(OH)2制备NH3
1. (2013·广东高考第32题节选)银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:

注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃
(1) 滤渣A与稀硝酸反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为 。
(2) 完成煅烧过程中一个反应的化学方程式: CuO+ Al2O3 CuAlO2+ ↑。
CuAlO2+ ↑。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com