
6. (1) 1s22s22p63s23p63d10(或[Ar]3d10) (2) 正四面体 (3) ①ac ②10mol(或10×6.02×1023或6.02×1024) ③6 (4) 3
5. (1) 1s22s22p63s23p63d6
(2) 7∶2 sp2 N2O4 (3) ①②③
(4) 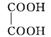
 CO↑+CO2↑+H2O
CO↑+CO2↑+H2O
C O或C≡O。
O或C≡O。
4. (1) 1s22s22p63s23p63d104s2(或[Ar]3d104s2)
(2) C<O<N (3) sp3 平面正三角形
(4) CO2或(N2O)
CaCN2+3H2O CaCO3+2NH3↑
CaCO3+2NH3↑
3. (1) 1s22s22p63s23p63d5 (2) ab
(3) 3∶2 [Fe(SCN)5]2- N>O>C O>N>C
(4) N2O(或CO2)
2. (1) 1s22s22p63s23p63d9 (2) sp2 平面三角形 3
(3)  N2 CN-(或
N2 CN-(或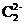 )
)
1. (1) 1s22s22p2 (2) NH3与H2O间能形成氢键 H3O+
(3) > (4) 原子 sp3 (5) acd
8. (2013·南京三模)黄血盐K4[Fe(CN)6]易溶于水,广泛用作食盐添加剂(抗结剂),食盐中黄血盐的最大使用量为10mg·kg-1。
请回答下列问题:
(1) 基态Fe2+的核外电子排布式为 。K4[Fe(CN)6]中Fe2+与CN-之间的化学键为 。
(2) CN-中碳原子的杂化方式为 ;1molCN-中含有π键的数目为 。
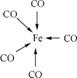
(3) 金属钾、γ-铁的晶体晶胞如右图所示,钾、γ-铁两种晶体晶胞中金属原子的配位数之比为 。
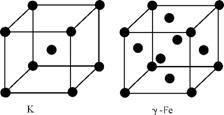
(4) 黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与CN-互为等电子体的气态化合物,反应的化学方程式为 。
物质结构与性质综合训练
7. (2013·连云港一模)铬及其化合物在工业中有重要用途。请回答下列问题:
(1) 基态铬原子的核外电子排布式为 。
(2) 沙瑞特试剂[(C5H5N)2·CrO3]是一种高选择性氧化剂。例如它可将乙醇氧化生成乙醛而不继续氧化生成乙酸。
①沙瑞特试剂组成元素中C、O、N的第一电离能从大到小的顺序为 。
②CH3CHO分子中C原子的杂化类型为 。
(3) 氯化铬酰(CrO2Cl2)的熔点:-96.5℃,沸点:117℃,能与CS2等互溶。则固态CrO2Cl2属于 晶体。已知N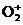 与CS2互为等电子体,则1molN
与CS2互为等电子体,则1molN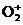 中含有π键数目为 。
中含有π键数目为 。
(4) 元素Cr的一种氮化物晶体的晶胞结构如右图所示,则该化合物的化学式为 。
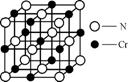
(5) 已知配合物CrCl3·6H2O中心原子Cr3+的配位数为6,向含0.1molCrCl3·6H2O的溶液中滴加2mol·L-1 AgNO3溶液,反应完全后共消耗AgNO3溶液50mL,则配离子的化学式为 。
6. (2013·盐城二模)我国部分城市灰霾天占全年一半,引起灰霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物及扬尘等。通过测定灰霾中锌等重金属的含量,可知目前造成我国灰霾天气的原因主要是交通污染。
(1) 基态Zn2+的核外电子排布式为 。
(2) S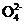 的空间构型是 (用文字描述)。
的空间构型是 (用文字描述)。
(3) PM2.5富含大量的有毒、有害物质,易引起二次光化学烟雾污染,光化学烟雾中含有NOx、O3、CH2 CH—CHO、HCOOH、
CH—CHO、HCOOH、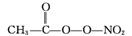 (PAN)等二次污染物。
(PAN)等二次污染物。
①下列说法正确的是 (填字母)。
a. N2O结构式可表示为N N
N O
O
b. O3分子呈直线形
c. CH2 CH—CHO分子中碳原子均采用sp2杂化
CH—CHO分子中碳原子均采用sp2杂化
d. 相同压强下,HCOOH沸点比CH3OCH3高,说明前者是极性分子,后者是非极性分子
②1molPAN中含σ键数目为 。
③NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中心离子的配位数为 。
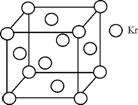
(4) 测定大气中PM2.5的浓度方法之一是β-射线吸收法,β-射线放射源可用85Kr。已知Kr晶体的晶胞结构如右图所示,该晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则 = 。
= 。
5. 菠菜中因含有较多的草酸(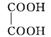 )而影响人体对钙、铁的吸收,故在烹饪前往往用热水焯一下以去除大部分的草酸。
)而影响人体对钙、铁的吸收,故在烹饪前往往用热水焯一下以去除大部分的草酸。
(1) 写出基态Fe2+的核外电子排布式: 。
(2) 草酸分子中的σ键与π键个数之比为 ,草酸中C原子的杂化方式是 ,与草酸根离子(C2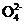 )互为等电子体的分子是 。
)互为等电子体的分子是 。
(3) 草酸钙(CaC2O4)中存在的化学键有 (填序号)。
①离子键 ②极性键 ③非极性键 ④配位键 ⑤金属键
(4) 草酸在浓硫酸、加热作用下脱水可产生CO气体,试写出该反应的化学方程式: ,生成的CO的结构式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com