
8. (17分)(2013·广州华师附中模拟)“结晶玫瑰”具有强烈的玫瑰香气,是一种很好的定香剂。其化学名称为“乙酸三氯甲基苯甲酯”,通常用三氯甲基苯基甲醇和醋酸酐为原料制备:
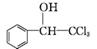 +(CH3CO)2O
+(CH3CO)2O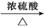
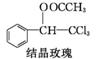 +CH3COOH
+CH3COOH
已知:
|
三氯甲基苯基甲醇 |
相对分子质量:225.5,无色液体,不溶于水,溶于乙醇 |
|
醋酸酐 |
无色液体,溶于水形成乙酸,溶于乙醇 |
|
结晶玫瑰 |
相对分子质量:267.5,白色至微黄色晶体,熔点:88℃,不溶于水,溶于乙醇,70℃时在乙醇中溶解度为ag |
|
醋酸 |
无色的吸湿性液体,易溶于水、乙醇 |
操作步骤如下:

 粗产品
粗产品
请根据以上信息,回答下列问题:
(1) 加料时,应先加入三氯甲基苯基甲醇和醋酸酐,然后慢慢加入浓硫酸并 。待混合均匀后,最适宜的加热方式为 (填“水浴加热”或“油浴加热”)。
(2) 粗产品的成分是结晶玫瑰与少量 的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。请完成表中内容。
|
序号 |
实验方案 |
实验现象 |
结论 |
|
① |
将粗产品溶解在 中,按粗产品、溶剂的质量比为1∶ 混合,用水浴加热到70℃回流溶剂使粗产品充分溶解 |
得到无色溶液 |
|
|
② |
将步骤1所得溶液 |
|
|
|
③ |
干燥步骤2所得白色晶体, |
|
白色晶体是结晶玫瑰 |
(3) 某同学欲在重结晶时获得较大的晶体,查阅资料得到如下信息:
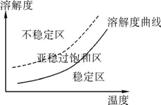
·不稳定区出现大量微小晶核,产生较多颗粒的小晶体 ·亚稳过饱和区,加入晶种,晶体生长 ·稳定区晶体不可能生长
由信息可知,从高温浓溶液中获得较大晶体的操作为 。
(4) 22.55g三氯甲基苯基甲醇与足量乙酸酐充分反应得到结晶玫瑰22.74g,则产率是 (保留两位有效数字)。
化学实验探究综合训练
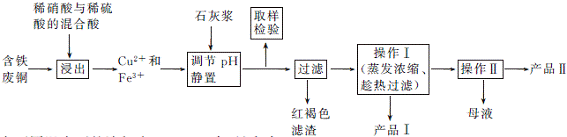
7. (17分)(2012·韶关二模)实验室由含铁废铜为原料生产胆矾(CuSO4·5H2O)和石膏(CaSO4·2H2O)的实验流程如下图所示:
相关物质在不同温度下的溶解度(g/100g水)见右表:
请回答下列问题:
|
温度/℃ |
20 |
40 |
60 |
80 |
100 |
|
石膏 |
0.32 |
0.26 |
0.15 |
0.11 |
0.07 |
|
胆矾 |
32 |
44.6 |
61.8 |
83.8 |
114 |
(1) 红褐色滤渣的主要成分是 (填化学式)。
(2) 在进行操作Ⅰ时的最佳温度是 ℃。
(3) 从溶液中分离出产品Ⅱ的操作Ⅱ应为 、过滤、 、干燥。
(4) 取样检验步骤中检验的是Fe3+,检验Fe3+最灵敏的试剂是大家熟知的KSCN,可以检验痕量Fe3+。还可用KI来检验:2Fe3++2I- 2Fe2++I2,有资料认为这可能是一个可逆反应。Fe3+与I-反应后的溶液显深红色,它是I2溶于KI溶液的颜色。为探究该深红色溶液中是否含Fe3+,进而证明这是否是一个可逆反应,试利用实验室常用仪器、用品及以下试剂设计方案并填写下表。
2Fe2++I2,有资料认为这可能是一个可逆反应。Fe3+与I-反应后的溶液显深红色,它是I2溶于KI溶液的颜色。为探究该深红色溶液中是否含Fe3+,进而证明这是否是一个可逆反应,试利用实验室常用仪器、用品及以下试剂设计方案并填写下表。
限选试剂:0.1mol·L-1FeCl3、KI、KSCN、NaOH、H2SO4、KMnO4溶液,CCl4,蒸馏水。
|
编号 |
实验操作 |
预期现象和结论 |
|
① |
在试管中加入少量FeCl3溶液和 (填“少量”或“过量”)的KI溶液 |
深红色如期出现 |
|
② |
将试管中的混合溶液转移至 (填仪器名称)中,倒入一定量的牋 |
|
|
③ |
|
|
6. (17分)(2013·潮州模拟)1-乙氧基萘是一种无色液体,密度比水大,不溶于水,易溶于乙醇,熔点为5.5℃,沸点为267℃。1-萘酚(性质与苯酚相似)的熔点为96℃,沸点为278℃,微溶于水,易溶于乙醇,乙醇的沸点为78.5℃。1-乙氧基萘常用作香料,也可合成其他香料。实验室制备1-乙氧基萘的过程如下:
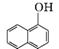 +C2H5OH
+C2H5OH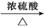
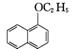 +H2O
+H2O
1-萘酚 1-乙氧基萘

图1
(1) 将72g1-萘酚溶于100mL无水乙醇中,加入5mL浓硫酸混合。将混合液置于如图1所示容器中加热充分反应。实验中使用过量乙醇的原因是 。烧瓶上连接长直玻璃管的主要作用是 。
(2) 反应结束,将烧瓶中的液体倒入冷水中,经处理得到有机层。为提纯产物有以下四步操作:①蒸馏;②水洗并分液;③用10%的NaOH溶液碱洗并分液;④用无水氯化钙干燥并过滤。正确的顺序是 (填字母)。
A. ③②④① B. ①②③④ C. ②①③④
(3) 实验测得1-乙氧基萘的产量与反应时间、温度的变化如图2所示,时间延长、温度升高,1-乙氧基萘的产量下降的原因可能是 、 。
(4) 某同学推测经提纯的产品可能还含有1-萘酚、乙醇、硫酸和水等杂质,设计了如下方案进行检验,请完成表中内容。
|
实验目的 |
实验操作 |
预期现象和结论 |
|
①用金属钠检验1-乙氧基萘是否纯净 |
取少量经提纯的产品于试管A中,加入金属钠 |
若 ,则产品纯净;若 ,则产品不纯 |
|
②检验经提纯的产品是否含有1-萘酚 |
|
若 ,则含有1-萘酚;若 ,则不含1-萘酚 |

图2
5. (17分)(2013·番禺模拟)硫代硫酸钠可用作照相业的定影剂、电镀业的还原剂、净水工程的净水剂。已知硫代硫酸盐的某些性质如下:(1)
S2 能被I2氧化为S4
能被I2氧化为S4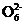 ;(2)
酸性条件下S2
;(2)
酸性条件下S2 迅速分解为S和SO2。
迅速分解为S和SO2。
Ⅰ. 市售硫代硫酸钠试剂中常含有硫酸根杂质,设计一个实验检验之。请完成下表:
|
实验步骤 |
预期现象 |
|
步骤1:取少量固体样品溶于无氧蒸馏水中 |
|
|
步骤2: |
|
|
步骤3: |
|
Ⅱ. 利用K2Cr2O7标准溶液可以定量测定市售硫代硫酸钠试剂的纯度。测定步骤如下:
①溶液配制:称取1.3000g硫代硫酸钠试样,用新煮沸并冷却的蒸馏水溶解后,加入少量碳酸钠固体,定容至100mL,避光放置7天。
②滴定:取10.00mL浓度为0.01000mol·L-1K2Cr2O7标准溶液,加入硫酸酸化后再加过量KI溶液(发生反应:Cr2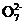 +I-
+I- I2+Cr3+)。然后加入某指示剂,用硫代硫酸钠滴定至终点(发生的反应为2S2
I2+Cr3+)。然后加入某指示剂,用硫代硫酸钠滴定至终点(发生的反应为2S2 +I2
+I2 S4
S4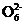 +2I-)。记录硫代硫酸钠溶液的用量,平行滴定3次。
+2I-)。记录硫代硫酸钠溶液的用量,平行滴定3次。
回答下列问题:
(1) 步骤①中必须用到的玻璃仪器有 。
(2) 完成并配平步骤②中给出的反应方程式: 。
(3) 本滴定实验要在 (填“强酸性”、“近中性”或“强碱性”)溶液中进行。
(4) 滴定过程中,指示剂应选用 。
(5) 若Na2S2O3溶液的平均用量为12.00mL,请计算样品的纯度(Na2S2O3·5H2O的摩尔质量为248g·mol-1,结果保留两位有效数字)。
4. (17分)(2013·茂名二模)草酸亚铁(FeC2O4·2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产。已知:CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉。回答下列问题:
Ⅰ. 兴趣小组对草酸亚铁的分解产物进行实验和探究。
(1) 将气体产物依次通过:
A. 澄清石灰水、B. 氯化钯,观察到A中澄清石灰水都变浑浊,B中出现黑色物质,上述现象说明气体产物中有 。
(2) 探究分解得到的固体产物中铁元素的存在形式。
①提出假设。
假设1: ;假设2:FeO;假设3:FeO和Fe混合物。
②设计实验方案证明假设3。
限选试剂:1.0mol·L-1盐酸、3%H2O2、0.1mol·L-1CuSO4、20%KSCN、蒸馏水。
|
实验步骤 |
现象与结论 |
|
步骤1:向试管中加入少量固体产物,再加入足量 ,充分振荡 |
若溶液颜色明显改变,且有 生成,则证明有铁单质存在 |
|
步骤2:将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液呈无色 |
|
|
步骤3:取步骤2中得到的少量固体于试管中,滴加牋 |
|
Ⅱ. 某草酸亚铁样品中含有少量草酸。现用滴定法测定该样品中FeC2O4的含量。滴定反应为5Fe2++5C2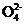 +3Mn
+3Mn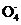 +24H+
+24H+ 5Fe3++10CO2↑+3Mn2++12H2O。
5Fe3++10CO2↑+3Mn2++12H2O。
实验方案设计如下:
①将准确称量的0.20g草酸亚铁样品置于250mL锥形瓶内,加入适量2mol·L-1H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000mol·L-1高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为V1mL。
②向上述滴定混合液中加入适量的Zn粉和过量的2mol·L-1H2SO4溶液,煮沸58min,用KSCN溶液在点滴板上检验点滴液,直至溶液不立刻变红。将滤液过滤至另一个锥形瓶中,继续用0.02000mol·L-1高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为V2mL。
③重复以上实验12次。
若某小组的一次测定数据记录如下:V1=18.90mL,V2=6.20mL。根据数据计算0.20g样品中:n(Fe2+)= ;n(C2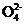 )= ;FeC2O4的质量分数为 (精确到0.01%)。
)= ;FeC2O4的质量分数为 (精确到0.01%)。
3. 离子交换膜 4. 冷却水
(1) 在反应3I2+6KOH 5KI+KIO3+3H2O中,氧化剂和还原剂的物质的量之比为 。
5KI+KIO3+3H2O中,氧化剂和还原剂的物质的量之比为 。
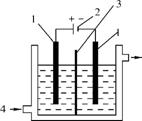
(2) 电解前,将KI和KIO3混合溶液加入阳极区,将氢氧化钾溶液加入阴极区,电解槽用水冷却。电解时,阳极上的电极反应式为 ;阴极上得到的气体产物为 。
(3) 某同学查资料获知:KIO3在酸性介质中与碘化物作用生成单质碘,该反应的离子方程式为 。为确定电解是否完成,需检验阳极区电解液中是否含有I-,该同学选用淀粉溶液和稀硫酸进行实验,其他仪器及用品自选,请完成其方案。
实验操作: 。
现象及结论: 。
(4) 电解完毕,从电解液中得到KIO3晶体的过程如下:
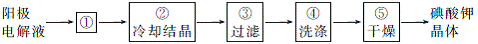
步骤①的操作名称 ,步骤④中洗涤晶体的目的 。
1. 惰性电极 2. 直流电源
3. (17分)(2013·惠州三调)碘酸钾(KIO3)晶体是我国规定的食盐加碘剂。它通常是以碘为原料与过量KOH溶液通过下列反应制得:3I2+6KOH 5KI+KIO3+3H2O,再将KI和KIO3的混合溶液电解,将其中的I-转化为I
5KI+KIO3+3H2O,再将KI和KIO3的混合溶液电解,将其中的I-转化为I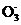 ,装置如右下图。
,装置如右下图。
2. (17分)(2013·肇庆一模)利用 Y 形管与其他仪器组合可以进行许多实验(固定装置略)。分析并回答下列问题:
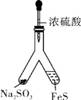
图1

图2
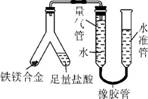
图3
(1) 实验目的:验证SO2的氧化性。将胶头滴管中浓硫酸分别滴入 Y形管的两个支管中,所产生的两种气体相遇发生反应:SO2+2H2S 3S↓+2H2O,则在支管交叉处实验现象为 ,硫化亚铁处加水的目的是 。
3S↓+2H2O,则在支管交叉处实验现象为 ,硫化亚铁处加水的目的是 。
(2) 实验目的:探究 SO2与BaCl2反应生成沉淀的条件。SO2通入BaCl2溶液并不产生沉淀,再通入另一种气体后就产生了白色沉淀。常温下,若由右侧Y形管产生另一种气体,则在其右侧Y形管应放置的药品是 和 ,导气管A的作用是 。
(3) 实验目的:铁镁合金中铁含量的测定。
①读取量气管中数据时,若发现水准管中的液面高于量气管中液面,应采取的措施是 。
②若称得铁镁合金的质量为0.080g,量气管中初读数为1.00mL,末读数为45.80mL(已折算为标准状况),则合金中铁的百分含量为 (精确到0.01%)。
1. (17分)(2013·湛江二模)为了探究SO2与Na2O2的反应是否类似于CO2,甲同学设计了如下图实验装置。回答下列问题:
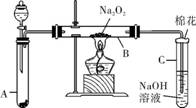
(1) 移开棉花,将带火星的木条放在C试管口,未见木条复燃。甲同学因此认为SO2与Na2O2的反应不同于CO2。请按甲同学的观点写出该反应的化学方程式: 。
(2) 乙同学认为无论反应原理如何,最终都有O2产生。乙同学的理由是 。按照乙同学的观点,该装置需作的改进是 。
(3) 假设Na2O2完全反应,反应后B装置中固体生成物可能是
①Na2SO3;②Na2SO4;③Na2SO3和Na2SO4。
请设计实验方案检验,写出实验步骤以及预期现象和结论,完成下表。
限选试剂:2mol·L-1HCl,1mol·L-1HNO3,1mol·L-1BaCl2,1mol·L-1Ba(NO3)2,0.01mol·L-1酸性KMnO4溶液。
|
实验步骤 |
预期现象和结论 |
|
步骤1:取B中的少量固体样品于试管中,滴加足量蒸馏水,溶解,然后取少量待测液分别置于Ⅰ、Ⅱ试管中 |
固体完全溶解 |
|
步骤2:往Ⅰ试管中加入 ,再滴加 |
,则证明生成物中含Na2SO4 |
|
步骤3:往Ⅱ试管中加入 |
若 ,则说明生成物中有Na2SO3;若 ,则说明生成物中没有Na2SO3 |
(4) ①生成物中亚硫酸钠含量的测定: 取ag生成物配制成100mL溶液,取10.00mL该溶液于锥形瓶中,加入几滴淀粉溶液作指示剂,用0.0100mol·L-1碘水进行滴定,滴定终点的现象为 ,记录数据,重复滴定2次,平均消耗碘水20.00mL。
②计算:生成物中亚硫酸钠的质量分数为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com