
1. (2013·南京学情调研)从生产印刷电路板(生产原理:2FeCl3+Cu 2FeCl2+CuCl2)的废液中提取CuCl2·2H2O晶体。实验流程如下:
2FeCl2+CuCl2)的废液中提取CuCl2·2H2O晶体。实验流程如下:
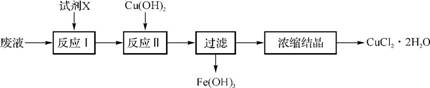
室温下,相关物质的溶度积常数如下表:
|
物质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
Ksp |
2.2×10-20 |
8.0×10-16 |
4.0×10-38 |
(1) 上述流程中试剂X可以选用 (填化学式)。反应Ⅱ调节溶液的pH为4.0,此时溶液中的c(Fe3+)= 。“浓缩结晶”需在低温下进行,其原因是 。
(2) 为控制试剂X的用量,对“废液”的组成进行如下测定:取20 mL废液,向其中加入足量的AgNO3溶液,得到的沉淀经过滤、洗涤、干燥,称量得17.22g;另取20mL废液,加入NaOH溶液至pH为4.0,将生成的沉淀经过滤、洗涤、灼烧至恒重,冷却后称量得0.64g。试计算废液中各种金属离子的物质的量浓度(写出计算过程)。
8. (1) 搅拌(1分) 油浴加热(1分) (2) 三氯甲基苯基甲醇(1分)
|
序号 |
实验方案 |
实验现象 |
结论 |
|
① |
无水乙醇(2分)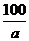 (2分) (2分) |
|
|
续表
|
② |
冷却结晶,抽滤(2分) |
|
|
|
③ |
加热使其熔化,测其熔点(2分) |
白色晶体在88℃左右完全熔化(2分) |
|
(3) 加入晶种,缓慢降温(2分) (4) 85%(2分)
7. (1) Fe(OH)3(2分) (2) 100(1分) (3) 冷却结晶(1分) 洗涤(1分)
(4)
|
编号 |
实验操作 |
预期现象和结论 |
|
① |
过量(2分) |
|
|
② |
分液漏斗(2分) CCl4,塞住活塞,充分振荡(萃取),静置(2分) |
液体分层,上层接近无色,下层紫红色(2分) |
|
③ |
打开活塞,先放出下层液体,再从分液漏斗的上口倒出水层于试管中,加入KSCN溶液(2分) |
出现血红色,则反应后的混合物中含Fe3+,进而证明该反应可逆;反之则不含Fe3+,进而证明该反应不可逆(2分) |
6. (1) 提高1-萘酚的转化率(或作溶剂)(2分) 冷凝回流,提高原料乙醇的利用率(2分)
(2) A(3分)
(3) 1-萘酚被氧化(2分) 温度高乙醇大量挥发(或温度高发生副反应)(2分)
(4) ①无气泡(1分) 有气泡产生(1分)
②取少量实验所得产品于试管中,加入12滴FeCl3溶液(2分)
显紫色(1分) 不显紫色(1分)
5. Ⅰ.
|
实验步骤 |
预期现象 |
|
|
固体完全溶解得无色澄清溶液(1分) |
|
加入过量盐酸(1分) |
有浅黄色浑浊出现、有刺激性气体产生(1分) |
|
静置后取上层清液,加入BaCl2溶液(1分) |
有白色沉淀产生,说明样品中含有硫酸根(1分) |
Ⅱ. (1) 烧杯、100mL容量瓶、玻璃棒、胶头滴管(2分)
(2) Cr2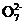 +14H++6I-
+14H++6I- 3I2+2Cr3++7H2O(2分)
3I2+2Cr3++7H2O(2分)
(3) 近中性(2分) (4) 淀粉(2分)
(5) 由Cr2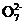 3I26S2
3I26S2 ,得
,得
c(S2 )·V(S2
)·V(S2 )=6c(Cr2
)=6c(Cr2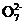 )·V(Cr2
)·V(Cr2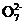 )
)
c(S2 )=
)=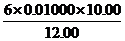 mol·L-1=0.05000mol·L-1
mol·L-1=0.05000mol·L-1
m(Na2S2O3·5H2O)=n(Na2S2O3·5H2O)×M(Na2S2O3·5H2O)=0.05000mol·L-1×0.100L×248g·mol-1=1.24g
样品的纯度为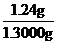 ×100%=95%(4分)
×100%=95%(4分)
44.64%(2分)
4. Ⅰ. (1) CO2、CO(2分) (2) ①Fe(1分)
②
|
实验步骤 |
现象与结论 |
|
步骤1:0.1mol·L-1CuSO4(2分) |
暗红色固体(2分) |
|
步骤3:过量1.0mol·L-1盐酸,静置,取上层清液,滴加适量H2O2,充分振荡后滴加KSCN(2分) |
若溶液呈血红色,则证明有FeO(2分) |
Ⅱ. n(Fe2+)=0.0006200mol(2分)
n(C2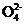 )=0.0006350mol(2分)
)=0.0006350mol(2分)
3. (1) 5∶1(2分)
(2) I-+6OH--6e- I
I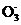 +3H2O(2分) H2(2分)
+3H2O(2分) H2(2分)
(3) I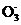 +5I-+6H+
+5I-+6H+ 3I2+3H2O(2分)
3I2+3H2O(2分)
取少量阳极区电解液于试管中,加稀硫酸酸化后,加入几滴淀粉溶液,观察是否变蓝(3分) 如果不变蓝,说明没有I-(如果变蓝,说明有I-)(2分)
(4) 蒸发浓缩(2分) 洗去吸附在碘酸钾晶体表面的氢氧化钾等杂质(2分)
2. (1) 管壁内有淡黄色固体生成(2分) 稀释浓硫酸,防止硫化氢被氧化(2分)
(2) 浓氨水(2分) 生石灰(或碱石灰、固体NaOH)(2分) 保持集气瓶内外气压平衡,以便左右两边产生的气体顺利导入(3分)
(3) ①放低(或移动)水准管位置,使水准管、量气管内液面相平(2分) ②70.00%(4分)
1. (1) SO2+Na2O2 Na2SO4(2分)
Na2SO4(2分)
(2) A中生成的SO2气体中含有水蒸气(2分) 在A和B之间连接一个装有浓硫酸的洗气瓶(2分)
(3)
|
步骤2:往Ⅰ试管中加入足量的1mol·L-1盐酸(1分),再滴加1mol·L-1BaCl2溶液(1分) |
有白色沉淀生成(1分),则证明生成物中含Na2SO4 |
|
步骤3:往Ⅱ试管中加入23滴0.01mol·L-1酸性KMnO4溶液,振荡(1分) |
若KMnO4溶液紫红色褪去(1分),则说明生成物中有Na2SO3;若KMnO4溶液紫红色不褪去(1分),则说明生成物中没有Na2SO3 |
(4) ①溶液出现蓝色,且半分钟内不褪去(2分)
②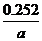 ×100%(3分)
×100%(3分)
解析 (1) SO2具有还原性,被Na2O2氧化为Na2SO4。
(2) 为防止Na2O2与水蒸气反应影响实验结果,该装置需要改进的是在A和B之间连接一个装有浓硫酸的洗气瓶。
(3) 检验S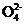 的方法为先加入足量的1mol·L-1盐酸,再滴加1mol·L-1BaCl2溶液,产生白色沉淀;检验S
的方法为先加入足量的1mol·L-1盐酸,再滴加1mol·L-1BaCl2溶液,产生白色沉淀;检验S 的方法为加入23滴0.01mol·L-1酸性KMnO4溶液,振荡,溶液褪色。
的方法为加入23滴0.01mol·L-1酸性KMnO4溶液,振荡,溶液褪色。
(4) 滴定终点为碘水过量一滴后的颜色,故现象为溶液出现蓝色,且半分钟内不褪去。Na2SO3的质量分数=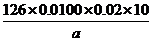 ×100%=
×100%=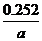 ×100%。
×100%。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com