
3. (1) Pb3O4+8H++2Cl- 3Pb2++Cl2↑+4H2O
3Pb2++Cl2↑+4H2O
(2) 2.8×10-8
mol·L-1 (3) 淀粉溶液 (4) 关系式为Pb3O49Na2S2O3,n(Pb3O4)= n(Na2S2O3)=
n(Na2S2O3)= ×0.100 0 mol·L-1×12. 00×10-3
L=1.333 3×10-4 mol, m(Pb3O4)=1.333 3×10-4
mol×685 g·mol-1=0.09133 g,即ω(Pb3O4)=91.33%
×0.100 0 mol·L-1×12. 00×10-3
L=1.333 3×10-4 mol, m(Pb3O4)=1.333 3×10-4
mol×685 g·mol-1=0.09133 g,即ω(Pb3O4)=91.33%
2. (1) 7.94×10-6 mol·L-1
(2) ①Ti(OR)4+4H2O(g) Ti(OH)4+4ROH ②抑制Ti3+的水解
Ti(OH)4+4ROH ②抑制Ti3+的水解
③三次滴定消耗标准溶液的平均值为24.00mL
TiO2 NH4Fe(SO4)2
80 1
m(TiO2) 0.02400L×0.1000
mol·L-1×
m(TiO2)=1.920 g
m(H2O)=2.010g-1.920 g=0.090 g
a∶b= ∶
∶ =24∶5
=24∶5
该样品的组成为24TiO2·5H2O。
1. (1) Cl2(或H2O2) 4.0×10-8mol·L-1
抑制CuCl2水解,且避免失结晶水
(2) n(Cl-)=n(AgCl)=17.22 g÷143.5 g·mol-1=0.12mol,n(Fe2O3)=0.64g÷160g·mol-1=0.004mol,n(Fe3+)=0.008
mol,c(Fe3+)=0.008 mol÷0.02L=0.4mol·L-1。根据电荷守恒得:n(Cu2+)+n(Fe2+)= =
= =0.048
mol,而根据2Fe3++Cu
=0.048
mol,而根据2Fe3++Cu 2Fe2++Cu2+,n(Cu2+)∶n(Fe2+)=1∶2,n(Cu2+)=
2Fe2++Cu2+,n(Cu2+)∶n(Fe2+)=1∶2,n(Cu2+)= =0.016mol,c(Cu2+)=0.016mol÷0.02L=0.8mol·L-1;n(Fe2+)=0.016
mol×2=0.032mol,c(Fe2+)=0.032 mol÷0.02L=1.6mol·L-1。所以c(Fe2+)=1.6mol·L-1,c(Cu2+)=0.8mol·L-1,c(Fe3+)=0.4mol·L-1。
=0.016mol,c(Cu2+)=0.016mol÷0.02L=0.8mol·L-1;n(Fe2+)=0.016
mol×2=0.032mol,c(Fe2+)=0.032 mol÷0.02L=1.6mol·L-1。所以c(Fe2+)=1.6mol·L-1,c(Cu2+)=0.8mol·L-1,c(Fe3+)=0.4mol·L-1。
8. (2012·苏北四市三模)纳米氧化亚铜(Cu2O)是一种用途广泛的光电材料,常用的制备方法有电化学法、湿化学法等。电化学法可用铜棒和石墨作电极,电解Cu(NO3)2稀溶液制备。湿化学法的制备过程为在KOH溶液中加入一定量的CuSO4溶液,再加入一定量的还原剂——肼(N2H4),加热并保持温度在90℃。检验反应完全后,分离、洗涤、真空干燥得到固体样品。反应的化学方程式如下:
4CuSO4+N2H4+8KOH 2Cu2O+N2↑+4K2SO4+6H2O
2Cu2O+N2↑+4K2SO4+6H2O
(1) 电化学法制备Cu2O时,铜棒作 极,阴极生成Cu2O的电极反应式为 。
(2) 湿化学法中,检验纳米Cu2O已经生成的实验方法是 。
(3) 湿化学法得到的产品中常含有Cu。称取某产品1.76g(设仅含Cu2O和Cu),加入足量的稀硝酸,充分反应后得到标准状况下的NO气体224mL,试计算产品中Cu2O的质量分数(写出计算过程)。
化学计算综合训练
7. (2013·南京三模)某复合肥的主要成分有KCl、NH4H2PO4和CO(NH2)2等。测定该复合肥中N的质量分数的实验步骤如下:
步骤1:准确称取0.5000g样品于锥形瓶中,加入足量浓硫酸并加热,不再有CO2逸出,冷却至室温。
步骤2:向锥形瓶中加入100mL蒸馏水,再加入适量的CaCl2溶液,并用NaOH溶液调节溶液近中性,过滤、洗涤,得0.1550gCa3(PO4)2沉淀和滤液A。
步骤3:向滤液A中加入过量甲醛溶液,加指示剂,用0.5000mol·L-1NaOH标准溶液滴定至终点,消耗NaOH溶液22.00mL。
已知:4N +6HCHO
+6HCHO 4H++(CH2)6N4+6H2O
4H++(CH2)6N4+6H2O
(1) 步骤1中,CO(NH2)2与硫酸反应的化学方程式为 。
(2) 欲使滤液A中c(P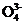 )≤4.0×10-6mol·L-1,应保持溶液中c(Ca2+)≥ mol·L-1。
)≤4.0×10-6mol·L-1,应保持溶液中c(Ca2+)≥ mol·L-1。
(已知:Ksp[Ca3(PO4)2]=2.0×10-33)
(3) 复合肥样品中N的质量分数为 。
(4) 计算复合肥样品中NH4H2PO4和CO(NH2)2的物质的量之比(写出计算过程)。
6. (2013·徐州考前模拟)某兴趣小组模拟氯碱工业生产原理并探究其产品的性质。已知文献记载:
①氯气与冷的氢氧化钠溶液反应生成NaClO;氯气与热的氢氧化钠溶液反应可生成NaClO和NaClO3。②在酸性较弱时KI只能被NaClO氧化,在酸性较强时亦能被NaClO3氧化。
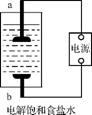
(1) 该小组利用如右图所示装置制取家用消毒液(主要成分为NaClO),则a为 (填“阳”或“阴”)极。生成NaClO的离子方程式为 。
(2) 该小组将0.784L(标准状况)Cl2通入50.00 mL热的NaOH溶液中,两者恰好完全反应后,稀释到250.0 mL。
Ⅰ. 取稀释后的溶液25.00 mL,用醋酸酸化,加入过量KI溶液。用0.2000
mol·L-1 Na2S2O3溶液滴定:I2+2S2
 2I-+S4
2I-+S4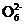 ,消耗Na2S2O3溶液10.00
mL时恰好到达终点。
,消耗Na2S2O3溶液10.00
mL时恰好到达终点。
Ⅱ. 将上述滴定后的溶液用盐酸酸化至强酸性,再用上述Na2S2O3溶液滴定到终点,需Na2S2O3溶液30.00 mL。
①操作Ⅱ中氯酸钠与碘化钾反应的离子方程式为 。
②反应后的溶液中次氯酸钠和氯酸钠的物质的量之比为 。
③氢氧化钠溶液的物质的量浓度为 。
5. (2013·淮安二模)以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备二氧化氯气体,再用水吸收获得二氧化氯溶液。在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2气体的吸收率。具体情况如右图所示。请回答下列问题:
(1) 据图可知,反应时需要控制的适宜温度是 ,达到此要求采取的适宜措施是 。
(2) 已知:黄铁矿中的硫元素在酸性条件下被Cl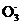 氧化成S
氧化成S ,写出制备二氧化氯的离子方程式: 。
,写出制备二氧化氯的离子方程式: 。
(3) 某校化学学习小组拟以“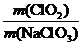 ”作为衡量ClO2产率的指标。若取NaClO3样品质量6.0g,通过反应和吸收可得400
mL ClO2溶液,取出20 mL,加入37.00 mL 0.500 mol·L-1(NH4)2Fe(SO4)2溶液充分反应,过量Fe2+再用0.0500
mol·L-1 K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下:
”作为衡量ClO2产率的指标。若取NaClO3样品质量6.0g,通过反应和吸收可得400
mL ClO2溶液,取出20 mL,加入37.00 mL 0.500 mol·L-1(NH4)2Fe(SO4)2溶液充分反应,过量Fe2+再用0.0500
mol·L-1 K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下:
4H++ClO2+5Fe2+ Cl-+5Fe3++2H2O,14H++Cr2
Cl-+5Fe3++2H2O,14H++Cr2 +6Fe2+
+6Fe2+ 2Cr3++6Fe3++7H2O
2Cr3++6Fe3++7H2O
试计算ClO2的“产率”(写出计算过程)。
4. (2013·扬州期末)硼镁矿属于硼酸盐,可用来制备硼酸(H3BO3)和MgO,方法如下:硼镁矿粉与(NH4)2SO4溶液混合后加热,反应生成H3BO3晶体和MgSO4溶液,同时放出NH3;再向MgSO4溶液中通入NH3与CO2,得到MgCO3沉淀和滤液,沉淀经洗涤、煅烧后得MgO,滤液则循环使用。回答下列问题:
(1) 与硅酸盐类似,硼酸盐结构也比较复杂,如硬硼钙石化学式为Ca2B6O11·5H2O,将其改写为氧化物的形式: 。
(2) 上述制备过程中,检验沉淀洗涤是否完全的方法是 。
(3) 写出MgSO4溶液中通入NH3与CO2发生反应的化学方程式: 。
(4) 若准确称取1.68 g硼镁矿,完全反应后得H3BO3晶体1.24 g、MgO 0.8 g,计算该硼酸盐的组成(写出计算过程)。

3. (2013·南方凤凰台百校大联考)红丹(Pb3O4)是制造油漆的原料。测定某红丹样品中Pb3O4质量分数的步骤如下:
①称取0.1000 g样品,用盐酸充分溶解并调节溶液至弱酸性;
②加入适当过量的K2Cr2O7标准溶液充分反应,析出PbCrO4沉淀:
2Pb2++Cr2 +H2O
+H2O 2PbCrO4↓+2H+
2PbCrO4↓+2H+
③过滤,沉淀用稀盐酸完全溶解后,再加入稍过量的KI,PbCrO4最终转化为Cr3+;
④步骤③生成的I2用0.1000 mol·L-1 Na2S2O3标准溶液滴定,至终点时消耗12.00 mL该标准溶液。
(I2+2Na2S2O3 Na2S4O6+2NaI)
Na2S4O6+2NaI)
(1) 步骤①中,Pb元素全部转化为Pb2+,同时还有黄绿色气体产生,该过程中发生反应的离子方程式为 。
(2) 已知室温下Ksp(PbCrO4)=2.8×10-13,若要使步骤②中Pb2+完全沉淀为PbCrO4[使溶液中c(Pb2+)≤1.0×10-5
mol·L-1],则溶液中c(Cr )≥ 。
)≥ 。
(3) 步骤④中选用的指示剂为 。
(4) 通过计算确定样品中Pb3O4的质量分数(写出计算过程)。
2. (2013·南京二模)TiO2在很多领域有着广泛的应用前景。
(1) 制备TiO2的常见方法:将TiCl4的水解产物加热脱水生成TiO2。已知常温下Ti(OH)4的Ksp=7.94×10-54,测得TiCl4水解后溶液的pH=2,则此时溶液中c(Ti4+)= 。
(2) 制备纳米TiO2的方法:以N2为载体,用钛醇盐Ti(OR)4和水蒸气反应生成Ti(OH)4,再控制温度生成纳米TiO2。温度控制不当会使产物含结晶水,测定产物aTiO2·bH2O组成的方法如下:
步骤一:取样品2.010g,在酸性条件下充分溶解,并用适量铝将TiO2+还原为Ti3+,过滤并洗涤,将所得滤液和洗涤液合并注入250mL容量瓶,并用稀硫酸定容,得待测液。
步骤二:取待测液25.00mL于锥形瓶中,加几滴KSCN溶液作指示剂,用0.1000 mol·L-1NH4Fe(SO4)2标准溶液滴定,将Ti3+氧化为TiO2+。重复滴定3次。滴定所得的相关数据如下表:
|
滴定序号 |
待测液体积/mL |
NH4Fe(SO4)2标准溶液 滴定管起点读数/mL |
NH4Fe(SO4)2标准溶液 滴定管终点读数/mL |
|
1 |
25.00 |
0.02 |
24.02 |
|
2 |
25.00 |
0.08 |
24.06 |
|
3 |
25.00 |
0.12 |
23.92 |
①钛醇盐Ti(OR)4和水蒸气反应的化学方程式为 。
②步骤一中用稀硫酸而不用水定容的原因是 。
③通过计算确定该样品的组成(写出计算过程)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com