
3. (2013·北京理综)NOx是汽车尾气中的主要污染物之一。
(1) NOx能形成酸雨,写出NO2转化为HNO3的化学方程式: 。
(2) 汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
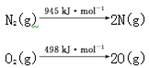
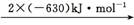 2NO(g)
2NO(g)
①写出该反应的热化学方程式: 。
②随温度升高,该反应的化学平衡常数将 (填“增大”、“减小”或“不变”)。
(3) 在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式: 。
(4) 通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
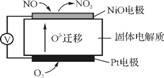
①Pt电极上发生的是 (填“氧化”或“还原”)反应。
②写出NiO电极的电极反应式: 。
2. (2013·常州一模)甲醇(CH3OH)和二甲醚被称为21世纪的新型燃料。以CH4和H2O为原料制备甲醇和二甲醚的工业流程如下:

(1) 写出催化反应室1中在一定条件下发生反应的化学方程式: 。
(2) 在压强为0.1MPa条件下,反应室3(容积为V
L)中a mol CO和2a molH2在催化剂作用下反应生成甲醇:CO(g)+2H2(g) CH3OH(g),CO的平衡转化率与温度、压强的关系如图1所示。
CH3OH(g),CO的平衡转化率与温度、压强的关系如图1所示。
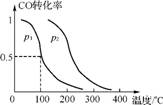
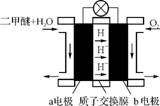
图1 图2
①p1 (填“<”、“>”或“=”)p2。
②在其他条件不变的情况下,反应室3再增加a mol CO和2a molH2,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”)。
③在p1压强下、100℃时,反应CH3OH(g) CO(g)+2H2(g)的平衡常数为 (用含a、V的代数式表示)。
CO(g)+2H2(g)的平衡常数为 (用含a、V的代数式表示)。
(3) 图2为绿色电源“二甲醚燃料电池”的工作原理示意图,a电极的电极反应式为 。
(4) 水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g) ΔH=-90.8kJ·mol-1
CH3OH(g) ΔH=-90.8kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41.3kJ·mol-1
CO2(g)+H2(g) ΔH=-41.3kJ·mol-1
则反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的ΔH= 。
CH3OCH3(g)+CO2(g)的ΔH= 。
1. (2013·镇江一模)研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义。
(1) 一定条件下,NO2与SO2反应生成SO3和NO两种气体。将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 (填字母)。
a. 体系压强保持不变
b. 混合气体颜色保持不变
c. 体系中SO3的体积分数保持不变
d. 每消耗1mol SO2的同时生成1molNO
测得上述反应平衡时NO2与SO2时体积比为1∶6,则平衡常数K= 。
(2) 新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为 (写出一种即可)。
16. BC
15. A
14. AC
13. BD
12. AC
11. D
10. BD
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com