
7.
(2013·全国新课标)锂离子电池的应用很广,某正极材料可再生利用,某锂离子电池的正极材料有钴酸锂(LiCoO2)、导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为6C+xLi++xe- LixC6,现欲利用以下工艺流程回收正极材料中某些金属资源(部分条件未给出)。
LixC6,现欲利用以下工艺流程回收正极材料中某些金属资源(部分条件未给出)。
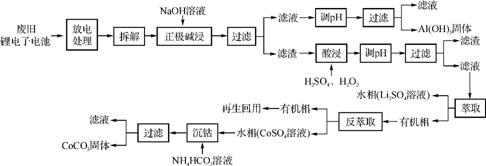
回答下列问题:
(1) LiCoO2中,Co元素的化合价为 。
(2) 写出“正极碱浸”中发生反应的离子方程式: 。
(3) “酸浸”一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式: ;可用盐酸代替H2SO4和H2O2的混合液,但缺点是 。
(4) 写出“沉钴”过程中发生反应的化学方程式: 。
(5) 充电过程中,发生LiCoO2与Li1-xCoO2之间的转化,写出放电时电池的总反应式: 。
(6) 上述工艺中,“放电处理”有利于锂在正极的回收,其原因是 ;在整个回收工艺中,可回收到的金属化合物有 (填化学式)。
工艺流程综合训练
6. (2012·苏北四市一模)CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿[主要成分为Co2O3、Co(OH)3,含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:
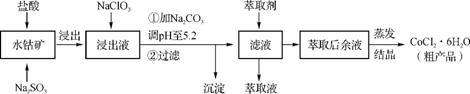
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
|
|
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
Mn(OH)2 |
|
开始沉淀 |
2.7 |
7.6 |
7.6 |
4.0 |
7.7 |
|
完全沉淀 |
3.7 |
9.6 |
9.2 |
5.2 |
9.8 |
(1) 写出浸出过程中Co2O3发生反应的离子方程式: 。
(2) NaClO3的作用是 。
(3) 加Na2CO3调pH至5.2所得沉淀为 (填化学式)。
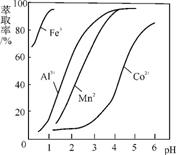
(4) 萃取剂对金属离子的萃取率与pH的关系如右图所示。萃取剂的作用是 ;其使用的适宜pH范围是 (填字母)。
A. 2.0 2.5 B. 3.0 3.5 C. 4.0 4.5
(5) 为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是 (任写一条)。
5. (2013·苏锡常镇二模)氧化铜矿石含有CuO和Cu2(OH)2CO3,还含有Fe2O3、FeO和SiO2等。铜、铁是畜禽所必需的微量元素。某饲料厂联合生产硫酸铜和硫酸亚铁的工艺流程如下:
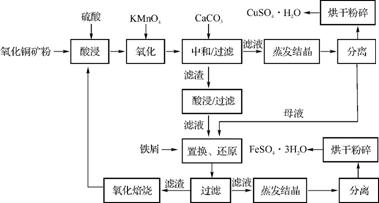
(1) 氧化铜矿石粉碎的目的是 。
(2) 写出“酸浸”中Cu2(OH)2CO3发生反应的离子方程式: 。
(3) “中和/过滤”中加入CaCO3的目的是 。
(4) 上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有 。
(5) 加入铁屑的作用是 、 。
(6) 下表和下图为“烘干粉碎”的实验结果。
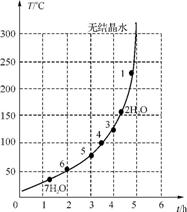
硫酸亚铁干燥曲线图
|
序号 |
t/h |
T/℃ |
m/g |
x |
|
1 |
3 |
80 |
5 |
4 |
|
2 |
3 |
160 |
10 |
1 |
|
3 |
4 |
160 |
10 |
0.8 |
|
4 |
4 |
160 |
5 |
0 |
|
5 |
5 |
80 |
5 |
3 |
|
6 |
5 |
160 |
15 |
1 |
硫酸铜晶体(CuSO4·5H2O)干燥实验表
表中,m为CuSO4·5H2O晶体的质量,x为干燥后所得晶体中结晶水的个数。据此可确定由CuSO4·5H2O和FeSO4·7H2O脱水的流程中所示产品的适宜工艺条件分别为 , (填两条件的温度和时间)。
4. 江苏有广阔的海岸线,海水的综合利用大有可为,海水中溴含量约为65 mg·L-1,从海水中提取溴的工业流程如下:
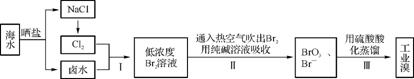
(1) 步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转化为化合态的溴,其目的是 。
(2) 步骤Ⅱ中涉及的离子反应如下,请在下面的方框内填入适当的化学计量数:
Br2+C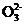 ——Br
——Br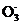 +Br-+CO2↑
+Br-+CO2↑
当生成标准状况下22.4 L CO2时,该反应转移的电子数为 。
(3) 上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的离子方程式: 。
(4) 实验室分离溴还可以用有机溶剂萃取法,萃取后如果要得到纯溴应如何操作? 。
(5) 氧化剂氯气来自电解饱和食盐水,电解槽使用了隔膜(或离子交换膜)来防止氯气与氢氧化钠溶液反应。
①电解时,阳极反应式为 。
②若采用无隔膜的电解槽,将得到H2和 (填化学式)。
3. (2013·苏锡常镇徐连六市调研)K2SO4是无氯优质钾肥,Mn3O4是生产软磁铁氧体材料的主要原料。以硫酸工业的尾气联合制备K2SO4和Mn3O4的工艺流程如下:
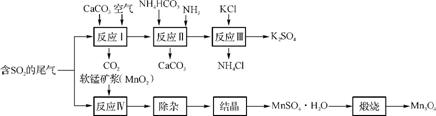
(1) 几种盐的溶解度见图1。反应Ⅲ中,向(NH4)2SO4溶液中加入KCl溶液充分反应后,进行蒸发浓缩、 、洗涤、干燥等操作即得K2SO4产品。
(2) 检验K2SO4样品是否含有氯化物杂质的实验操作是 。
(3) 反应Ⅳ的化学方程式为 。
(4) Mn3O4与浓盐酸加热时发生反应的离子方程式为 。
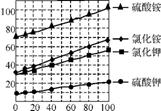
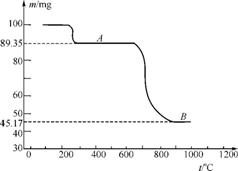
图1 图2
(5) 图2是煅烧MnSO4·H2O时剩余固体质量与温度的变化曲线。
①该曲线中B点所表示物质的化学式为 。
②煅烧过程中固体锰含量随温度的升高而增大,但当温度超过1000℃时,再冷却后,测得产物的总锰含量反而减小。试分析产物总锰含量减小的原因: 。
2. (2012·南师附中最后一卷)一种以黄铜矿和硫黄为原料制取铜和其他产物的新工艺,原料的综合利用率较高。其主要流程如下:
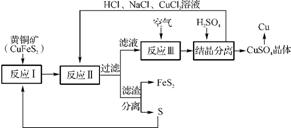
已知:①反应Ⅰ的化学方程式为CuFeS2+S FeS2+CuS,FeCuS2中S的化合价为-2价。
FeS2+CuS,FeCuS2中S的化合价为-2价。
②反应Ⅱ滤液的主要成分为CuC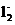 。
。
(1) 为使反应Ⅰ充分进行,工业上可采取的措施是 ;反应Ⅰ生成12 g FeS2转移的电子数为 。
(2) 反应Ⅱ的离子方程式为 。
(3) 反应Ⅲ通入空气的目的是 。一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其原因是 。
(4) 以黄铜矿(主要成分是CuFeS2)为原料制备铜,也可以采用“火法熔炼工艺”。“火法熔炼工艺”中的“焙烧”程序,是在通入少量空气的情况下使黄铜矿部分脱硫生成焙砂(主要成分是Cu2S和FeO)和SO2,该反应的化学方程式为 。
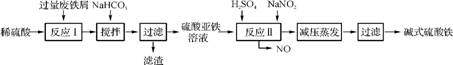
1. (2013·镇江调研)工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:
部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
|
沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
|
开始沉淀 |
2.3 |
7.5 |
3.4 |
|
完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1) 加入少量NaHCO3的目的是调节pH,使溶液中的 (填“Fe3+”、“Fe2+”或“Al3+”)沉淀,该工艺中“搅拌”的作用是 。
(2) 在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作 。若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为 。
(3) 碱式硫酸铁溶于水后产生的Fe(OH)2+,可部分水解生成Fe2(OH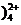 聚合离子。该水解反应的离子方程式为 。
聚合离子。该水解反应的离子方程式为 。
(4) 在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及N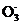 。为检验所得产品中是否含有Fe2+,应使用的试剂为 (填字母)。
。为检验所得产品中是否含有Fe2+,应使用的试剂为 (填字母)。
A. 氯水 B. KSCN溶液 C. NaOH溶液 D. 酸性KMnO4溶液
8. (1) ②
(2) CuO 调节溶液pH至4.4,除去Fe3+(或降低溶液酸度,除去Fe3+)
(3) ①2H2O+2e- 2OH-+H2↑
2OH-+H2↑
②Cu+Cl--e- CuCl↓ ③CuOH和Cu2O Ksp(CuOH)<Ksp(CuCl),CuCl转化为黄色的CuOH沉淀,CuOH不稳定分解生成Cu2O,所以橙黄色沉淀为CuOH和Cu2O的混合物 ④Cu2O 取少量样品放入试管,滴加少量稀硫酸,观察到沉淀部分溶解且溶液呈蓝色,说明沉淀成分为Cu2O
CuCl↓ ③CuOH和Cu2O Ksp(CuOH)<Ksp(CuCl),CuCl转化为黄色的CuOH沉淀,CuOH不稳定分解生成Cu2O,所以橙黄色沉淀为CuOH和Cu2O的混合物 ④Cu2O 取少量样品放入试管,滴加少量稀硫酸,观察到沉淀部分溶解且溶液呈蓝色,说明沉淀成分为Cu2O
7. (1) SrSO4(s)+C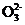 (aq)
(aq) SrCO3(s)+S
SrCO3(s)+S (aq)
(aq)
K=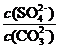 因为Ksp(SrCO3)<Ksp(SrSO4),加入C
因为Ksp(SrCO3)<Ksp(SrSO4),加入C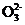 后,使得SrSO4(s)
后,使得SrSO4(s) Sr2+(aq)+S
Sr2+(aq)+S (aq)向正反应方向移动,生成SrCO3
(aq)向正反应方向移动,生成SrCO3
(2) ①减小 ②不变
(3) 盐酸 若沉淀完全溶解,则证明SrSO4完全转变为SrCO3,否则未完全转化
(4) 不严密,溶液中可能含有S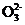 ,生成的BaSO3能被硝酸氧化成BaSO4
,生成的BaSO3能被硝酸氧化成BaSO4
6. (1) 4H2(g)+2NO2(g) N2(g)+4H2O(g)
N2(g)+4H2O(g)
ΔH=-1034.9kJ·mol-1
(2) 增大NH3浓度(或减小压强、降低温度)
(3) 2NO2+4Na2SO3 N2+4Na2SO4 67.5
N2+4Na2SO4 67.5
(4) 阳极 N2O4+2HNO3-2e- 2N2O5+2H+
2N2O5+2H+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com