
3. (2013·扬州模拟)直接氧化法制备混凝剂聚合硫酸铁[Fe2(OH)n(SO4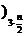 ]m(n>2,
m≤10)的实验流程如下:
]m(n>2,
m≤10)的实验流程如下:
30gFeSO4·7H2O
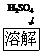
 调pH
调pH
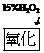
 水解、聚合
水解、聚合 浓缩、烘干
浓缩、烘干 聚合硫酸铁(PFS)
聚合硫酸铁(PFS)
已知:盐基度=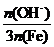 ×100%。式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量。所得产品若要用于饮用水处理,需达到盐基度指标为
8.0%16.0%。
×100%。式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量。所得产品若要用于饮用水处理,需达到盐基度指标为
8.0%16.0%。
(1) 实验加入硫酸的作用是 。取样分析Fe2+浓度,其目的是 。
(2) 用pH试纸测定溶液pH的操作方法为 。若溶液的pH偏小,将导致聚合硫酸铁中铁的质量分数 (填“偏高”、“偏低”或“无影响”)。
(3) 氧化时控制反应温度为5060℃的原因是 。
(4) 聚合反应的原理为m[Fe2(OH)n(SO4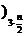 ]
] [Fe2(OH)n(SO4
[Fe2(OH)n(SO4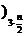 ]m,则水解反应的化学方程式为 。
]m,则水解反应的化学方程式为 。
(5) 产品盐基度的测定方法:
Ⅰ. 称取m g固体试样,置于400 mL聚乙烯烧杯中,加入25 mL盐酸标准溶液,再加20 mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿。
Ⅱ. 室温下放置10 min,再加入10 mL氟化钾溶液,摇匀,掩蔽Fe3+,形成白色沉淀。
Ⅲ. 加入5滴酚酞指示剂,立即用物质的量浓度为c mol·L-1的氢氧化钠标准液滴定至终点,消耗体积为V mL。
Ⅳ. 向聚乙烯烧杯中,加入25 mL盐酸标准溶液,再加20 mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿。然后重复Ⅱ、Ⅲ做空白试验,消耗氢氧化钠标准液的体积为V0 mL。
①达到滴定终点的现象为 。
②已知试样中Fe3+的质量分数为w1,则该试样的盐基度(w)的计算表达式为 。
2. (2013·宿迁、徐州三模)碳酸钠 过氧化氢加合物(aNa2CO3·bH2O2)具有漂白、杀菌作用。实验室用“醇析法”制备该物质的实验步骤如下:
过氧化氢加合物(aNa2CO3·bH2O2)具有漂白、杀菌作用。实验室用“醇析法”制备该物质的实验步骤如下:
第1步:取适量碳酸钠溶解于一定量水中,倒入烧瓶中;再加入少量稳定剂(MgCl2和Na2SiO3),搅拌均匀。
第2步:将适量30%的H2O2溶液在搅拌状态下滴入烧瓶中,于15℃左右反应1h。
第3步:反应完毕后再加入适量无水乙醇,静置、结晶,过滤,干燥得产品。
(1) 第1步中,稳定剂与水反应生成2种常见的难溶物,其化学方程式为 。
(2) 第2步中,反应保持为15℃左右可采取的措施是 。
(3) 第3步中,无水乙醇的作用是 。
(4) H2O2的含量可衡量产品的伪劣。现称取mg(约0.5g)样品,用新煮沸过的蒸馏水配制成250mL溶液,取25.0mL于锥形瓶中,先用稀硫酸酸化,再用c mol·L-1 KMnO4溶液滴定至终点。
①配制250mL溶液所需的玻璃仪器有烧杯、玻璃棒、量筒、 、 。 ?
②滴定终点的现象是 。
(1) 可模拟用蒸馏法测定样品中碳酸钠的含量。装置如右图所示(加热和固定装置已略去),实验步骤如下:
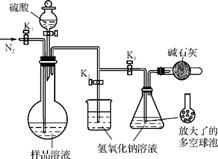
步骤1:按右图所示组装仪器,检查装置气密性。
步骤2:准确量取(4)中所配溶液50mL于烧瓶中。
步骤3:准确量取40.00mL约0.2mol·L-1 NaOH溶液2份,分别注入烧杯和锥形瓶中。
步骤4:打开活塞K1、K2,关闭活塞K3,缓缓通入氮气一段时间后,关闭K1、K2,打开K3;经滴液漏斗向烧瓶中加入10mL 3mol·L-1硫酸。
步骤5:加热至烧瓶中的液体沸腾,蒸馏,并保持一段时间。
步骤6:经K1再缓缓通入氮气一段时间。
步骤7:向锥形瓶中加入酸碱指示剂,用c1 mol·L-1 H2SO4标准溶液滴定至终点,消耗H2SO4标准溶液V1 mL。
步骤8:将实验步骤17重复2次。
①步骤3中,准确移取40.00mL NaOH溶液所使用的仪器是 。
②步骤17中,确保生成的二氧化碳被氢氧化钠溶液完全吸收的实验步骤是 (填序号)。
③为获得样品中碳酸钠的含量,还需补充的实验是 。
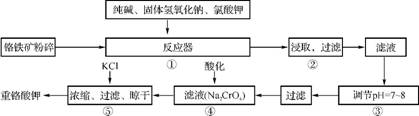
1. (2013·汇龙中学模拟)重铬酸钾(K2Cr2O7)是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3)为原料来生产。实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺流程如下,涉及的主要反应是6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3+7KCl+12H2O。
12Na2CrO4+3Fe2O3+7KCl+12H2O。
试回答下列问题:
(1) 在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,写出氧化铝与碳酸钠反应的化学方程式: 。
(2) NaFeO2能强烈水解,在操作②生成沉淀而除去,写出该反应的化学方程式: 。
(3) 操作③的目的是什么,用简要的文字说明: 。
(4) 操作④中,酸化时Cr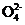 转化为Cr2
转化为Cr2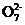 ,写出平衡转化的离子方程式: 。
,写出平衡转化的离子方程式: 。
(5) 称取重铬酸钾试样2.5000g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL
2mol·L-1H2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.1200
mol·L-1Na2S2O3标准溶液滴定(I2+2S2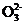
 2I-+S4
2I-+S4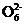 )。
)。
①判断达到滴定终点的现象是 。
②若实验中共用去Na2S2O3标准溶液40.00mL,则所得产品中重铬酸钾的纯度(设整个过程中其他杂质不参与反应)为 。
7. (1) +3
(2) 2Al+2OH-+2H2O 2Al
2Al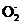 +3H2↑
+3H2↑
(3) 2LiCoO2+3H2SO4+H2O2 Li2SO4+2CoSO4+O2↑+4H2O、2H2O2
Li2SO4+2CoSO4+O2↑+4H2O、2H2O2 2H2O+O2↑ 有氯气生成,污染较大
2H2O+O2↑ 有氯气生成,污染较大
(4) CoSO4+2NH4HCO3 CoCO3↓+(NH4)2SO4+H2O+CO2↑
CoCO3↓+(NH4)2SO4+H2O+CO2↑
(5) Li1-xCoO2+LixC6 LiCoO2+6C
LiCoO2+6C
(6) 放电时,Li+从负极中脱出,经由电解质向正极移动并进入正极材料中 Al(OH)3、CoCO3、Li2SO4
6. (1) Co2O3+S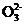 +4H+
+4H+ 2Co2++S
2Co2++S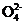 +2H2O
+2H2O
(2) 将Fe2+氧化成Fe3+ (3) Fe(OH)3、Al(OH)3 (4) 除去溶液中的Mn2+ B (5) 粗产品含有可溶性氯化物或晶体失去了部分结晶水
5. (1) 增大接触面积,加快化学反应速率
(2) Cu2(OH)2CO3+4H+ 2Cu2++3H2O+CO2↑
2Cu2++3H2O+CO2↑
(3) 适当降低溶液的酸性,使Fe3+水解成沉淀而分离
(4) 烧杯、玻璃棒、漏斗 (5) 使母液中Fe3+转化为Fe2+ 除去Cu2+,提高硫酸亚铁晶体的纯度 (6) 160℃、3h 125(±5)℃、4h
4. (1) 富集(或浓缩)溴元素 (2)
3 3 1 5 3 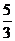 NA(或
NA(或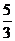 ×6.02×1023)
×6.02×1023)
(3) SO2+Br2+2H2O 4H++2Br-+S
4H++2Br-+S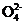
(4) 蒸馏
(5) ①2Cl--2e- Cl2↑ ②NaClO
Cl2↑ ②NaClO
3. (1) 趁热过滤 (2) 取少量样品于试管中配成溶液,滴加过量Ba(NO3)2溶液,再取上层清液滴加AgNO3溶液
(3) MnO2+SO2 MnSO4
MnSO4
(4) Mn3O4+8H++2Cl- 3Mn2++Cl2↑+4H2O
3Mn2++Cl2↑+4H2O
(5) ①Mn3O4 ②部分Mn3O4又被氧化为Mn2O3或MnO2,造成总锰含量减小
2. (1) 粉碎固体等 0.1 mol
(2) CuS+4Cl-+Cu2+ S+2CuC
S+2CuC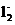
(3) 使反应Ⅱ生成的一价铜离子被氧化成二价铜离子 硫酸铜的溶解度小于氯化铜的溶解度
(4) 2CuFeS2+4O2 Cu2S+3SO2+2FeO
Cu2S+3SO2+2FeO
1. (1) Al3+ 加快反应速率(或使反应物充分接触) (2) 氧化剂 2mol
(3) 2[Fe(OH)]2++2H2O [Fe2(OH)4]2++2H+
[Fe2(OH)4]2++2H+
(4) D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com