
1. (2013·扬泰南连淮三模)硅藻土是由硅藻死亡后的遗骸沉积形成的,主要成分是 SiO2和有机质,并含有少量的Al2O3、Fe2O3、MgO 等杂质。下图是生产精制硅藻土并获得Al(OH)3的工艺流程。
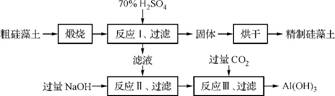
(1) 粗硅藻土高温煅烧的目的是 。
(2) 反应Ⅲ中生成Al(OH)3沉淀的化学方程式是 ;氢氧化铝常用作阻燃剂,其原因是 。
(3) 实验室用酸碱滴定法测定硅藻土中硅含量的步骤如下:
步骤1:准确称取样品a g,加入适量KOH固体,在高温下充分灼烧,冷却,加水溶解。
步骤2:将所得溶液完全转移至塑料烧杯中,加入硝酸至强酸性,得硅酸浊液。
步骤3:向硅酸浊液中加入NH4F溶液、饱和KCl溶液,得K2SiF6沉淀,用塑料漏斗过滤并用饱和KCl溶液洗涤。
步骤4:将K2SiF6转移至另一烧杯中,加入一定量蒸馏水,采用70
℃水浴加热使其充分水解(K2SiF6+3H2O H2SiO3+4HF+2KF)。
H2SiO3+4HF+2KF)。
步骤5:向上述水解液中加入数滴酚酞,趁热用浓度为c mol·L-1 NaOH的标准溶液滴定至终点,消耗NaOH标准溶液V mL。
①步骤1中高温灼烧实验所需的仪器除三角架、泥三角、酒精喷灯外还有 (填字母)。
a. 蒸发皿 b. 表面皿 c. 瓷坩埚 d. 铁坩埚
②实验中使用塑料烧杯和塑料漏斗的原因是 。
③步骤3中采用饱和KCl溶液洗涤沉淀,其目的是 。
④步骤5中滴定终点的现象为 。
⑤样品中SiO2的质量分数可用公式“w(SiO2)=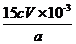 ×100%”进行计算。由此分析步骤5中滴定反应的离子方程式为 。
×100%”进行计算。由此分析步骤5中滴定反应的离子方程式为 。
6. (1) 漏斗、玻璃棒、烧杯 BaSO4和Fe(OH)3
(2) 静置,取少许上层清液于试管中,加入BaCl2,若无白色沉淀,则S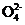 已沉淀完全
已沉淀完全
(3) 蒸发结晶 趁热过滤 冷却结晶
(4) ①Cl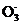 +6Fe2++6H+
+6Fe2++6H+ 6Fe3++Cl-+3H2O
6Fe3++Cl-+3H2O
②78.2%
5. Ⅰ. (1) 蒸馏烧瓶 CD
(2) S2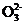 +SO2+H2O
+SO2+H2O S↓+2HS
S↓+2HS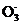
Ⅱ. (3) 趁热过滤 乙醇 (4) 温度过高会导致析出的晶体分解 (5) ①酸式 ②溶液由无色变为浅红色,半分钟内不褪色 ③96.9%
4. (1) 2KClO3+H2C2O4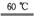 K2CO3+CO2↑+2ClO2↑+H2O
K2CO3+CO2↑+2ClO2↑+H2O
(2) 温度计 冰水浴 (3) ①高于38
℃蒸发浓缩结晶 ②趁热过滤 (4) ①减小实验误差 ②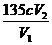
3. (1) 抑制Fe2+水解 确定氧化Fe2+所需H2O2的量
(2) 将pH试纸放在点滴板(或表面皿)上,用玻璃棒蘸取少量待测液滴在试纸上,迅速与标准比色卡对照 偏低 (3) 温度过低,反应太慢;温度过高, H2O2分解加快,导致氧化剂用量增加
(4) Fe2(SO4)3+nH2O Fe2(OH)n(SO4
Fe2(OH)n(SO4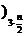 +
+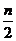 H2SO4 (5)
①烧杯中液体颜色恰好为浅红色,且30s内不变色
H2SO4 (5)
①烧杯中液体颜色恰好为浅红色,且30s内不变色
②w=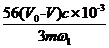 ×100%
×100%
2. (1) MgCl2+Na2SiO3+2H2O 2NaCl+Mg(OH)2↓+H2SiO3↓ (2)
15℃水浴
2NaCl+Mg(OH)2↓+H2SiO3↓ (2)
15℃水浴
(3) 降低碳酸钠 过氧化氢加合物的溶解度(有利于晶体析出) (4)
①250mL 容量瓶 胶头滴管 ②溶滴呈浅红色且30s内不褪色 (5) ①碱式滴定管 ②1,5,6 ③用H2SO4标准溶液滴定NaOH溶液的浓度
过氧化氢加合物的溶解度(有利于晶体析出) (4)
①250mL 容量瓶 胶头滴管 ②溶滴呈浅红色且30s内不褪色 (5) ①碱式滴定管 ②1,5,6 ③用H2SO4标准溶液滴定NaOH溶液的浓度
1. (1) Al2O3+Na2CO3 2NaAlO2+CO2↑
2NaAlO2+CO2↑
(2) NaFeO2+2H2O Fe(OH)3↓+NaOH
Fe(OH)3↓+NaOH
(3) 除去Si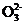 和Al
和Al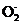
(4) 2Cr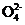 +2H+
+2H+ Cr2
Cr2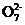 +H2O
+H2O
(5) ①溶液蓝色褪去且30 s内不恢复 ②94.08%
6. (2013·盐城中学模拟)氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:
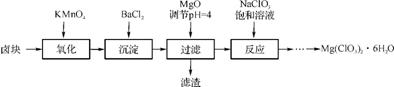
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②几种化合物的溶解度(S)随温度(T)的变化曲线如下图所示。
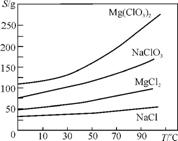
(1) 过滤所需要的主要玻璃仪器有 ,加MgO后过滤所得滤渣的主要成分为 。
(2) 加入BaCl2的目的是除去S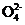 ,如何检验S
,如何检验S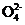 已沉淀完全?
。
已沉淀完全?
。
(3) 加入NaClO3饱和溶液发生的反应为MgCl2+2NaClO3 Mg(ClO3)2+2NaCl↓,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为① ;② ;③ ;④过滤、洗涤。
Mg(ClO3)2+2NaCl↓,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为① ;② ;③ ;④过滤、洗涤。
(4) 产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:量取10 mL于锥形瓶中,加入10 mL稀硫酸和20 mL 1.000 mol·L-1 FeSO4溶液,微热。
步骤3:冷却至室温,用0.100
mol·L-1 K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为Cr2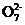 +6Fe2++14H+
+6Fe2++14H+ 2Cr3++6Fe3++7H2O。
2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00 mL。
①写出步骤2中发生反应的离子方程式: 。
②产品中Mg(ClO3)2·6H2O的质量分数为 。
化学实验综合训练
5. (2013·海安高级中学、南京外国语学校、南京金陵中学调研)硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3+S Na2S2O3。常温下溶液中析出晶体为Na2S2O3·5H2O。Na2S2O3·5H2O于4045℃熔化,48℃分解;Na2S2O3
易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如图2所示。
Na2S2O3。常温下溶液中析出晶体为Na2S2O3·5H2O。Na2S2O3·5H2O于4045℃熔化,48℃分解;Na2S2O3
易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如图2所示。
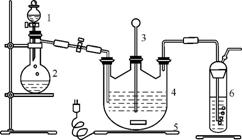
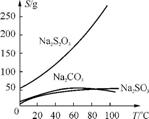
图1 图2
Ⅰ. 现按如下方法制备Na2S2O3·5H2O:
将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中注入浓盐酸,在装置2中加入亚硫酸钠固体,并按图1安装好装置。
(1) 仪器2的名称为 ,装置6中可放入 (填字母)。
A. BaCl2溶液 B. 浓硫酸
C. 酸性KMnO4溶液 D. NaOH溶液
(2) 打开分液漏斗活塞,注入浓盐酸使反应产生的二氧化硫气体较均匀的通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,反应原理如下:
①Na2CO3+SO2 Na2SO3+CO2
Na2SO3+CO2
②Na2S+SO2+H2O Na2SO3+H2S
Na2SO3+H2S
③2H2S+SO2 3S↓+2H2O
3S↓+2H2O
④Na2SO3+S Na2S2O3
Na2S2O3
总反应为2Na2S+Na2CO3+4SO2 3Na2S2O3+CO2
3Na2S2O3+CO2
随着SO2气体的通入,看到溶液中有大量浅黄色固体析出,继续通SO2气体,反应约半小时至固体消失,即可停止通气和加热。若继续通入SO2,又会析出浅黄色沉淀,写出此时发生反应的离子方程式: 。
Ⅱ. 分离Na2S2O3·5H2O并测定含量:
热的反应混合物
 滤液
滤液

 粗晶体
粗晶体
(3) 为减少产品的损失,操作①为 ,操作②是抽滤洗涤干燥,其中洗涤操作是用 (填试剂名称)作洗涤剂。
(4) 蒸发浓缩滤液直至溶液呈微黄色浑浊为止,蒸发时为什么要控制温度不宜过高? 。(5) 制得的粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用KMnO4标准溶液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。
称取1.28 g粗样品溶于水,用0.40mol·L-1
KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2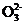 全部被氧化时,消耗KMnO4溶液体积20.00
mL。(5S2
全部被氧化时,消耗KMnO4溶液体积20.00
mL。(5S2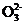 +8Mn
+8Mn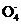 +14H+
+14H+ 8Mn2++10S
8Mn2++10S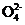 +7H2O)
+7H2O)
①KMnO4溶液置于 (填“酸式”或“碱式”)滴定管中。
②滴定终点时的颜色变化为 。
③产品中Na2S2O3·5H2O的质量分数为 。
4. (2013·镇江一模)二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59 ℃,沸点为11.0 ℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60 ℃时反应制得。某学生拟用左下图所示装置模拟工业制取并收集ClO2。
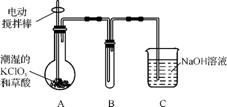
(1) A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式: 。
(2) A必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、 ;B也必须添加温度控制装置,应该是 (填“冰水浴”或“热水浴”)装置。
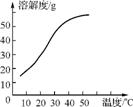
(3) 反应后在装置C中可得NaClO2溶液。已知NaClO2饱和溶液中在温度低于38 ℃时析出的晶体是NaClO2·3H2O,在温度高于38℃时析出的晶体是NaClO2。根据右上图所示的NaClO2的溶解度曲线,请补充从NaClO2溶液中制得NaClO2的操作步骤:
① ;② ;③洗涤;④干燥。
(4) ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样;量取V1 mL试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用c mol·L-1
Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2
mL。(已知:2Na2S2O3+I2 Na2S4O6+2NaI)
Na2S4O6+2NaI)
①滴定过程中,至少需进行两次平行测定的原因是 。
②原ClO2溶液的浓度为 (用步骤中字母的代数式表示)g·L-1。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com