
3. (2013·镇江期末)盐酸阿立必利是一种强效止吐药。它的合成路线如下:

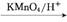
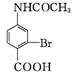

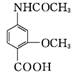
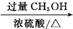

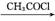
A B C D
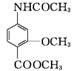

 …
… 盐酸阿立必利
盐酸阿立必利
E F
(1) 有机物D中含有的官能团有酯基、 、 (填官能团名称)。
(2) 由E生成F的反应类型为 。
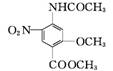
(3) 在 C→D的反应中,可能得到副产物H(分子式为C11H13NO4)。H的结构简式为 。
(4) 写出同时满足下列条件的D的一种同分异构体G的结构简式: 。
①属于α 氨基酸
氨基酸
②能与FeCl3溶液发生显色反应
③分子中有一个手性碳原子,有6种不同化学环境的氢
(5) 高聚物I由G通过肽键连接而成,I的结构简式是 。
(6) 写出由C生成D的化学方程式: 。
(7) 已知: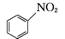
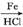
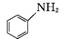 。请写出以
。请写出以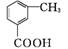 、CH3CH2CH2COCl、CH3OH为原料制备
、CH3CH2CH2COCl、CH3OH为原料制备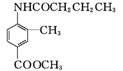 的合成路线流程图(无机试剂任用)。
的合成路线流程图(无机试剂任用)。
合成路线流程图示例如下:
CH2 CH2
CH2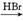 CH3CH2Br
CH3CH2Br CH3CH2OH
CH3CH2OH
2. (2013·盐城二模)托卡朋是基于2012年诺贝尔化学奖的研究成果开发的治疗帕金森氏病药物,《瑞士化学学报》公布的一种合成路线如下:

(1) C→D的反应类型为 。
(2) 化合物F中含氧官能团有羟基、 和 (填官能团名称)。
(3) 写出同时满足下列条件的D的一种同分异构体的结构简式: 。
①能与Br2发生加成反应 ②是萘(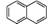 )的衍生物,且取代基都在同一个苯环上 ③在酸性条件下水解生成的两种产物都只有4种不同化学环境的氢
)的衍生物,且取代基都在同一个苯环上 ③在酸性条件下水解生成的两种产物都只有4种不同化学环境的氢
(4) 实现A→B的转化中,叔丁基锂[(CH3)3CLi]转化为(CH3)2C CH2,同时有LiBr生成,则X(分子式为C15H14O3)的结构简式为 。
CH2,同时有LiBr生成,则X(分子式为C15H14O3)的结构简式为 。
(5) 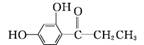 是合成神经兴奋剂回苏灵的中间体,请写出以CH3CH2CH2Br和
是合成神经兴奋剂回苏灵的中间体,请写出以CH3CH2CH2Br和 为原料(原流程图条件中的试剂及无机试剂任选)制备该化合物的合成路线流程图。合成路线流程图示例如下:
为原料(原流程图条件中的试剂及无机试剂任选)制备该化合物的合成路线流程图。合成路线流程图示例如下:
CH2 CH2
CH2 CH3CH2OH
CH3CH2OH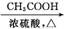 CH3COOC2H5
CH3COOC2H5
1. (2013·扬泰南连淮三模)莫沙朵林是一种镇痛药,它的合成路线如下:

(1) B中手性碳原子数为 ;化合物D中含氧官能团的名称为 。
(2) C与新制氢氧化铜反应的化学方程式为 。
(3) 写出同时满足下列条件的E的一种同分异构体的结构简式: 。
Ⅰ. 核磁共振氢谱有4个峰
Ⅱ. 能发生银镜反应和水解反应
Ⅲ. 能与FeCl3溶液发生显色反应
(4) 已知E+X→F为加成反应,化合物X的结构简式为 。
(5) 已知:
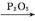
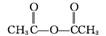 。化合物
。化合物
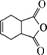 是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以
是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以  和
和  为原料合成该化合物(用合成路线流程图表示,并注明反应条件)。合成路线流程图示例如下:
为原料合成该化合物(用合成路线流程图表示,并注明反应条件)。合成路线流程图示例如下:
CH3CH2OH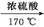 CH2
CH2 CH2
CH2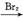
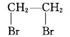
4. (1) 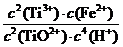
(2) 防止NH4HCO3分解(或减少Fe2+的水解)
FeSO4+2NH4HCO3 FeCO3↓+H2O+CO2↑+(NH4)2SO4
FeCO3↓+H2O+CO2↑+(NH4)2SO4
取少量溶液A于试管中,滴入KSCN溶液,无明显现象,再滴入氯水,溶液呈血红色,证明含有Fe2+;反之,不含有Fe2+
(3) C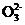 与乳酸反应,其浓度降低,使平衡向右移动,碳酸亚铁溶解得到乳酸亚铁
与乳酸反应,其浓度降低,使平衡向右移动,碳酸亚铁溶解得到乳酸亚铁
(4) 有利于水的蒸发 防止Fe2+被氧化
3. (1) 2HCl+NH4Cl NCl3+3H2↑ 控制好反应温度
NCl3+3H2↑ 控制好反应温度
(2) NCl3+6Cl +3H2O
+3H2O 6ClO2↑+NH3↑+3Cl-+3OH-
6ClO2↑+NH3↑+3Cl-+3OH-
(3) ①最后一滴滴入后,溶液由蓝色变成无色,且30s内不变色 ②
2. (1) 粉碎矿石(或适当升高温度或搅拌)
(2) Cu2S+2MnO2+4H2SO4 2CuSO4+2MnSO4+S↓+4H2O
2CuSO4+2MnSO4+S↓+4H2O
(3) 3.2≤pH<4.4 使Fe3+转化为Fe(OH)3沉淀而除去
(4) NH3
(5) 碱式碳酸铜产量减少
(6) 混有硫酸盐杂质(或部分晶体失去结晶水)
1. (1) 除去有机质
(2) NaAlO2+CO2+2H2O Al(OH)3↓+NaHCO3 氢氧化铝分解吸收热量,且生成高熔点的氧化铝覆盖在表面
Al(OH)3↓+NaHCO3 氢氧化铝分解吸收热量,且生成高熔点的氧化铝覆盖在表面
(3) ①d ②实验中产生的HF能与玻璃仪器中的SiO2等物质反应 ③洗去沉淀表面的HF等杂质;增大K+浓度,减少K2SiF6的损失 ④最后一滴滴入后溶液由无色变为粉红色,且30 s内不褪色 ⑤HF+OH- F-+H2O
F-+H2O
4. (2013·宿迁、徐州三模)某研究小组利用工业生产钛白粉产生的废液(含有大量的Fe2+、H+、S2-和少量的Fe3+、TiO2+)生产乳酸亚铁,其工艺流程如下:
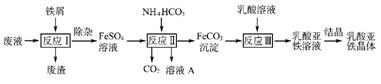
(1) 反应Ⅰ中,铁屑与TiO2+反应的离子方程式为2TiO2++Fe+4H+ 2Ti3++Fe2++2H2O,该反应的平衡常数表达式为K= 。
2Ti3++Fe2++2H2O,该反应的平衡常数表达式为K= 。
(2) 反应Ⅱ需控制反应温度低于35 ℃,其目的是 ,该反应的化学方程式是 。检验溶液A中是否含Fe2+的实验操作方法是 。
(3) 已知:FeCO3(s) Fe2+(aq)+C
Fe2+(aq)+C (aq),试用平衡移动原理解释反应Ⅲ中生成乳酸亚铁的原因: 。
(aq),试用平衡移动原理解释反应Ⅲ中生成乳酸亚铁的原因: 。
(4) 结晶过程必须控制在一定的真空度条件下进行,原因有① ;
② 。
专题六 化学工艺流程题型研究
3. (2013·扬州中学质量检测)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下:
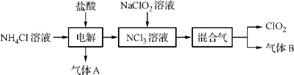
已知:①NCl3是黄色黏稠状液体或斜方形晶体,极易爆炸,有类似氯气的刺激性气味,自然爆炸点为95℃,在热水中易分解,在空气中易挥发,不稳定。②气体B能使湿润的红色石蕊试纸变蓝。
(1) 电解时,发生反应的化学方程式为 。为保证实验的安全,在电解时需注意的问题有①控制好生成的NCl3的浓度;② 。
(2) NCl3与NaClO2(亚氯酸钠)按物质的量之比1∶6混合,在溶液中恰好反应生成ClO2,该反应的离子方程式为 。
(3) ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验。
步骤1:准确量取ClO2溶液10 mL,稀释成100 mL试样。
步骤2:量取V1 mL试样于锥形瓶中,调节试样pH≤2.0,加入足量KI晶体,摇匀,在暗处静置30 min。
步骤3:以淀粉溶液作指示剂,用c mol·L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
(已知I2+2S2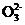
 2I-+S4
2I-+S4 )
)
①上述步骤3中滴定终点的现象是 。
②根据上述步骤可计算出原ClO2溶液的浓度为 (用含字母的代数式表示)g·L-1。
2. (2013·苏州调研)辉铜矿主要成分为Cu2S,软锰矿主要成分为MnO2,它们都含有少量SiO2、Fe2O3等杂质。工业上综合利用这两种矿物制备硫酸锰和碱式碳酸铜的主要工艺流程如下:
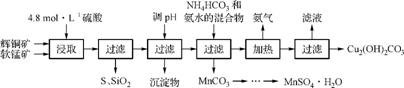
已知:①MnO2能将金属硫化物中的硫氧化为单质硫;②[Cu(NH3)4]SO4常温下稳定,在热水中会分解生成NH3;③部分金属阳离子生成氢氧化物沉淀的pH范围如右表所示。
(1) 酸浸时,为了提高浸取率可采取的措施有 (任写一点)。
|
|
开始沉淀的pH |
沉淀完全的pH |
|
Fe3+ |
1.1 |
3.2 |
|
Mn2+ |
8.3 |
9.8 |
|
Cu2+ |
4.4 |
6.4 |
(2) 酸浸时,得到的浸出液中主要含有CuSO4、MnSO4等。
写出该反应的化学方程式: 。
(3) 调节浸出液pH的范围为 ,其目的是 。
(4) 本工艺中可循环使用的物质是 (写化学式)。
(5) 在该工艺的“加热驱氨”环节,若加热的温度过低或过高,都将造成 的结果。
(6) 用标准BaCl2溶液测定样品中MnSO4·H2O质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其可能原因是 (任写一种)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com