
7. (2013·苏锡常镇四市一调)铁铝合金是一种新型高温结构材料。
(1) 右图表示室温时不同组份的Fe3Al在65%浓硝酸中的腐蚀情况。由右图可看出添加了 (填符号)元素的合金耐蚀性最差。

(2) 高温条件下,Al和Fe2O3按一定比例混合反应可制得Fe3Al,写出该反应的化学方程式: 。
(3) 某校兴趣小组欲测定另一种铁铝硅合金(FexAlySiz)粉末的组成。
①小明同学提出如下方案:准确称取1.46g该合金粉末,再加入足量NaOH溶液(Si+2NaOH+H2O Na2SiO3+2H2↑),充分反应后过滤,通过测定剩余固体质量及收集到气体的体积,可计算出此合金的组成。写出Al与NaOH溶液反应的离子方程式: 。
Na2SiO3+2H2↑),充分反应后过滤,通过测定剩余固体质量及收集到气体的体积,可计算出此合金的组成。写出Al与NaOH溶液反应的离子方程式: 。
②小军同学认为该方案难以测定标准状况下气体的体积,操作不简便。于是他设计了第二种方案:准确称取1.46g该合金粉末,加入过量盐酸溶液充分反应后过滤,测定剩余固体质量0.07g;向滤液中滴加足量浓NaOH溶液,充分搅拌、过滤、洗涤得固体;再将所得固体充分加热、灼烧得红棕色粉末1.60g。试通过计算确定此合金的组成(写出计算过程)。
专题二 有关物质的量的基本计算
6. (2013·无锡期末改编)从含镁、钾盐湖水中蒸发最后得到的产物中含光卤石(xKCl·yMgCl2·zH2O),它在空气中极易潮解、易溶于水,是制造钾肥和提取金属镁的重要原料,其组成可通过下列实验测定:①准确称取5.550 g样品溶于水,配成100 mL溶液。②将溶液分成两等份,在一份中加入足量的NaOH溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.580g。③在另一份溶液中加入足量的稀硝酸酸化的AgNO3溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体4.305g。
(1) 步骤②中检验白色固体已洗净的方法是 。
(2) 通过计算确定样品的组成(写出计算过程)。
(3) 若步骤③中沉淀未完全烘干便直接称量,则所得化合物中z值将 (填“偏高”、“偏低”或“无影响”)。
5. (2012·苏北四市一调)肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料。
(1) 肼用亚硝酸氧化可生成氮的另一种氢化物,该氢化物的相对分子质量为43,其中氮原子的质量分数为97.7%。写出肼与亚硝酸反应的化学方程式: 。
(2) 肼和四氧化二氮作火箭推进剂,两者反应产物是氮气和水。当反应生成28.0 kg还原产物时,计算参加反应的肼的质量(写出计算过程)。
4. (2013·泰州三模)乙二酸(H2C2O4)是一种重要的化工产品,可以使酸性高锰酸钾溶液褪色,其制备工艺流程如下:

氧化时控制反应液温度为5560℃,边搅拌边缓慢滴加浓硝酸、H2SO4混合液,可发生下列反应:
C6H12O6+18HNO3 3H2C2O4+18NO2↑+12H2O
3H2C2O4+18NO2↑+12H2O
C6H12O6+6HNO3 3H2C2O4+6NO↑+6H2O
3H2C2O4+6NO↑+6H2O
(1) 检验氧化后的溶液中是否仍含有葡萄糖的实验方案为 。
(2) 氧化时控制反应液温度为5560℃的原因是 。
(3) 若水解时淀粉利用率为80%,氧化时葡萄糖的利用率为80%,结晶时有10%乙二酸遗留在溶液中。则30kg淀粉可生产乙二酸的质量为 。
(4) 生产中产生的NOx用氧气和水吸收后产生硝酸循环利用,若尾气NOx中n(NO2)∶n(NO)=2∶1,且NOx的吸收转化率为90%。计算:理论上,每生产9kg乙二酸至少需要补充质量分数为63%的硝酸溶液的质量(写出计算过程)。
3. (2013·苏州期末调研改编)摩尔盐[xFeSO4·y(NH4)2SO4·zH2O]是一种重要化工原料。其组成可通过下列实验测定:
①称取1.5680 g 样品,准确配成100 mL溶液A。
②量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.4660 g。
③再量取25.00 mL溶液A,滴加适量稀硫酸,用0.0200 mol·L-1KMnO4溶液滴定至终点,生成Mn2+,消耗KMnO4溶液10.00 mL。
(1) 步骤①配制溶液A必须使用的仪器是 (填字母)。
A. 25 mL滴定管 B. 胶头滴管 C. 100 mL容量瓶
(2) ③中发生反应的离子方程式为 ,滴定终点的现象是 。
(3) 通过计算确定样品的组成(写出计算过程)。
2. (2014·南京期初调研)铁铵矾[x(NH4)2SO4·yFe2(SO4)3·zH2O]是一种重要的指示剂。某同学为测定铁铵矾的组成,进行如下实验:①准确称取2.892 0 g样品,配制成100.00 mL溶液A;②准确量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.699 0 g;③准确量取25.00 mL溶液A,用适量Zn将Fe3+转化为Fe2+,再用0.010 00 mol·L-1 K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL。
(1) Cr2 与Fe2+反应生成Cr3+,其离子方程式为 。
与Fe2+反应生成Cr3+,其离子方程式为 。
(2) 通过计算确定铁铵矾的化学式(写出计算过程)。
1. (2012·南京二模)聚合硫酸铁可用于自来水厂净化水源,它在水中生成的胶体能吸附镉等重金属离子。
(1) 镉镍碱性电池放电时,负极的Cd转化为Cd(OH)2,正极的NiO2转化为Ni(OH)2,写出该电池的总反应式: 。
(2) 双氧水氧化法制备聚合硫酸铁:在反应器中加入硫酸亚铁、硫酸和水,搅拌混合,缓慢加入H2O2,反应得到聚合硫酸铁。该过程中加入H2O2不能太快,原因是 。
(3) 聚合硫酸铁的化学式可表示为[Fea(OH)b(SO4)c]m。取一定量聚合硫酸铁样品与足量盐酸反应,将所得溶液平均分为两等份。一份溶液中加入足量的BaCl2溶液,得到白色沉淀1.7475 g。另一份溶液,加热煮沸后,滴加稍过量SnCl2溶液,使Fe3+还原为Fe2+,用甲基橙除去过量SnCl2。然后用0.02000 mol·L-1 K2Cr2O7标准溶液滴定,到达滴定终点时共用去K2Cr2O7标准溶液50.00 mL。计算聚合硫酸铁晶体中a、b、c的最简整数比(写出计算过程)。
(已知:Cr2 +6Fe2++14H+
+6Fe2++14H+ 2Cr3++6Fe3++7H2O)
2Cr3++6Fe3++7H2O)
8. (1) 取代反应
(2) 羟基、醚键 3
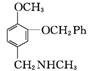
(3) 
(4) 
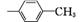 、
、
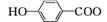

(5) CH2 CH2
CH2 CH3CH2Br
CH3CH2Br CH3CH2CN
CH3CH2CN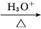 CH3CH2COOH
CH3CH2COOH



7. (1) 
(2) 1 消去反应 (3) N
(4)  或
或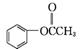
或
(5) 
6. (1) 香料分子中含有酚羟基,易被氧化
(2) 醚键、酚羟基 加成反应
(3) 
(4) 2
(5) 
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com