
2.(2013·浙江联考)pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值。如某溶液中某溶质的浓度为1×10-3mol·L-1,则该溶液中该溶质的pC=-lg(1×10-3)=3。右图为25℃时H2CO3溶液的pC pH图。(若离子浓度小于10-5
mol·L-1,可认为该离子不存在)
pH图。(若离子浓度小于10-5
mol·L-1,可认为该离子不存在)
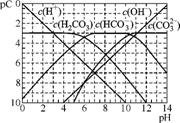
(1) 在同一溶液中,H2CO3、HC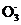 、C
、C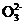 (填“能”或“不能”)大量共存。
(填“能”或“不能”)大量共存。
(2) 当pH=7时,溶液中含碳元素的主要微粒的物质的量浓度的大小关系为 。
(3) H2CO3一级电离平衡常数Ka1≈ 。
(4) 解释pH<5的溶液中H2CO3的pC总是约等于3的原因是 。
(5) 人体血液中主要通过碳酸氢盐缓冲体系(H2CO3/HC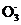 )可以抵消少量酸或碱,维持pH≈7.4。当过量的酸进入血液中时,血液缓冲体系中的
)可以抵消少量酸或碱,维持pH≈7.4。当过量的酸进入血液中时,血液缓冲体系中的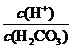 最终将 (填字母)。
最终将 (填字母)。
A. 变大 B. 变小 C. 基本不变 D. 无法判断
1.右图是某水溶液在pH从0至14的范围内H2CO3、HC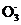 、C
、C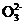 三种成分平衡时的组成分数。
三种成分平衡时的组成分数。

(1) 人体血液的pH约为7.4,则CO2在血液中多以 (填存在形式的化学式)形式存在。
(2) 若用CO2和NaOH反应制取NaHCO3,应控制溶液的pH范围是 。
(3) 在pH分别为6.37及10.25时,溶液中三种成分的关系分别是 和 。
(4) 现在用0.0100 mol·L-1 HCl溶液滴定0.0100mol·L-1碳酸钠溶液,用酚酞作指示剂,达到滴定终点的离子方程式是 。
(5) 常温下,在碳酸钠和碳酸氢钠混合溶液中滴加稀盐酸至中性时,溶质的主要成分有 。
0.02 mol 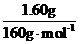
m(Fe)=0.02 mol×56 g·mol-1=1.12 g
m(Al)=1.46 g-1.12 g-0.07 g=0.27 g
n(Al)=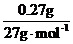 =0.01
mol
=0.01
mol
x∶y∶z=0.02 mol∶0.01 mol∶0.002 5 mol=8∶4∶1
故该合金的组成为Fe8Al4Si
7. (1) Si (2) 3Fe2O3+8Al 2Fe3Al+3Al2O3
2Fe3Al+3Al2O3
(3) ①2Al+2OH-+2H2O 2Al
2Al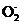 +3H2↑
+3H2↑
②Si不溶于盐酸,则n(Si)=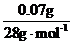 =0.0025
mol,
=0.0025
mol,
根据铁元素的守恒求得铁的物质的量
2Fe Fe2O3
2 mol 1 mol
6. (1) 取最后一次洗涤液,滴加AgNO3溶液,若不产生沉淀,则固体已洗净
(2) 5.550g样品中:
n(Mg2+)=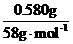 ×2=0.02mol
×2=0.02mol
n(MgCl2)=0.02mol
m(MgCl2)=0.02 mol×95 g·mol-1=1.9 g
n(Cl-)= ×2=0.06mol
×2=0.06mol
n(KCl)=0.06mol-2×0.02mol=0.02mol
m(KCl)=0.02 mol×74.5 g·mol-1=1.49 g
n(H2O)=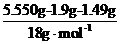 =0.12mol
=0.12mol
样品中n(KCl)∶n(MgCl2)∶n(H2O)=1∶1∶6
光卤石的化学式为KCl·MgCl2·6H2O
(3) 偏低
5. (1) N2H4+HNO2 HN3+2H2O
HN3+2H2O
(2) 根据2N2H4+N2O4 3N2+4H2O找出参加反应的N2H4与还原产物N2之间的关系式:
3N2+4H2O找出参加反应的N2H4与还原产物N2之间的关系式:
2N2H4 N2
64 28
m(N2H4) 28.0 kg
m(N2H4)=64×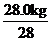 =64.0
kg
=64.0
kg
4. (1) 取氧化后所得溶液,加入过量NaOH溶液,再向其中加入新制Cu(OH)2加热。若有砖红色沉淀产生,说明含有葡萄糖 (2) 若温度过低反应过慢,若温度过高硝酸会分解(或挥发) (3) 28.8kg
(4) 设每产生9kgH2C2O4反应中产生NO2的物质的量为x,产生NO的物质的量为y。
C6H12O6+18HNO3 3H2C2O4+18NO2↑+12H2O
3H2C2O4+18NO2↑+12H2O
18 3 18
x 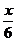 x
x
C6H12O6+6HNO3 3H2C2O4+6NO↑+6H2O
3H2C2O4+6NO↑+6H2O
6 3 6
y 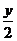 y
y
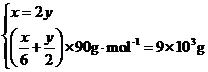
x=240mol,y=120mol
需补充的硝酸m(HNO3)=360mol×(1-90%)×63g·mol-1÷63%=3600g=3.6kg
3. (1) BC
(2) Mn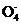 +5Fe2++8H+
+5Fe2++8H+ Mn2++5Fe3++4H2O 溶液由无色变为浅红色且30
s内不褪色
Mn2++5Fe3++4H2O 溶液由无色变为浅红色且30
s内不褪色
(3) n(S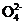 )=n(BaSO4)=
)=n(BaSO4)=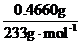 =2.000×10-3
mol
=2.000×10-3
mol
n(Fe2+)=5×n(Mn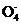 )=5×0.0200
mol·L-1×0.010 0 L=1.000×10-3 mol
)=5×0.0200
mol·L-1×0.010 0 L=1.000×10-3 mol
n(N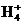 )=2×2.000×10-3
mol-2×1.000×10-3mol=2.000×10-3mol
)=2×2.000×10-3
mol-2×1.000×10-3mol=2.000×10-3mol
m(FeSO4)=1.000×10-3 mol×152 g·mol-1=0.152 g
m[(NH4)2SO4]=1.000×10-3 mol×132 g·mol-1=0.132 g
n(H2O)=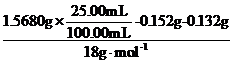 =6.000×10-3mol
=6.000×10-3mol
x∶y∶z=n(FeSO4)∶n[(NH4)2SO4]∶n(H2O)=1∶1∶6
该摩尔盐的化学式为FeSO4·(NH4)2SO4·6H2O
2. (1) 6Fe2++Cr2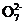 +14H+
+14H+ 2Cr3++6Fe3++7H2O
2Cr3++6Fe3++7H2O
(2) n(S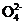 )=n(BaSO4)=
)=n(BaSO4)= =3.00×10-3
mol
=3.00×10-3
mol
n(Fe3+)=n(Fe2+)=6×0.010 00 mol·L-1×25.00×10-3 L=1.50×10-3 mol
由电荷守恒知:n(N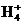 )=2n(S
)=2n(S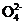 )-3n(Fe3+)=2×3.00×10-3
mol-3×1.50×10-3 mol=1.50×10-3 mol
)-3n(Fe3+)=2×3.00×10-3
mol-3×1.50×10-3 mol=1.50×10-3 mol
即m[(NH4)2SO4]=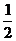 ×1.50×10-3
mol×132 g·mol-1=0.099 0 g
×1.50×10-3
mol×132 g·mol-1=0.099 0 g
m[Fe2(SO4)3]=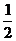 ×1.50×10-3
mol×400 g·mol-1=0.300 0 g
×1.50×10-3
mol×400 g·mol-1=0.300 0 g
n(H2O)=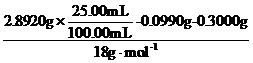 =1.80×10-2 mol
=1.80×10-2 mol
故x∶y∶z=n[(NH4)2SO4]∶n[Fe2(SO4)3]∶n(H2O)=1∶1∶24
铁铵矾的化学式为(NH4)2SO4·Fe2(SO4)3·24H2O
1. (1) Cd+NiO2+2H2O Cd(OH)2+Ni(OH)2
Cd(OH)2+Ni(OH)2
(2) 若加入过快,H2O2有可能来不及与物料充分反应就被分解
(3) n(S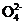 )=
)=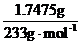 =0.0075
mol
=0.0075
mol
n(K2Cr2O7)=0.05×0.020 00 mol=0.001 mol
n(Fe2+)=n(K2Cr2O7)×6=0.006 mol
n(OH-)+n(S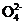 )×2=n(Fe3+)×3
)×2=n(Fe3+)×3
n(OH-)=0.006 mol×3-0.007 5 mol×2=0.003 mol
a∶b∶c=0.006 mol∶0.003 mol∶0.0075 mol=4∶2∶5
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com