
4. 3.7 8×10-7
3. 6.0×10-6 mol·L-1
2. (1) 不能 (2) c(HC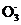 )>c(H2CO3)>c(C
)>c(H2CO3)>c(C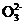 ) (3)
10-6 (4) 该溶液为碳酸的饱和溶液 (5) A
) (3)
10-6 (4) 该溶液为碳酸的饱和溶液 (5) A
1. (1) HC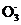 (2)
8左右
(2)
8左右
(3) c(H2CO3)=c(HC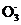 ) c(HC
) c(HC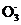 )=c(C
)=c(C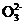 ) (4)
C
) (4)
C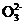 +H+
+H+ HC
HC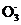 (5)
NaHCO3、NaCl、H2CO3
(5)
NaHCO3、NaCl、H2CO3
8. (2013·广东高三专题训练改编)水体中二价汞离子可以与多种阴离子结合成不同的存在形态。水溶液中二价汞主要存在形态与Cl-、OH-的浓度关系如右图所示[注:粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-lgc(Cl-)]。
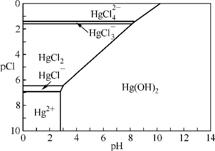
(1) 正常海水(Cl-的浓度大于0.1mol·L-1) 中汞元素的主要存在形态是 。少量Hg(NO3)2溶于0.001 mol·L-1盐酸后得到无色透明溶液,其中汞元素的主要存在形态是 。
(2) Hg(NO3)2固体易溶于水,但溶于水时常常会出现浑浊,其原因是 (用离子方程式表示),为了防止出现浑浊,可采取的措施是 。
(3) 处理含汞废水的方法很多。下面是常用的两种方法,汞的回收率是很高。
①置换法:用废铜屑处理含Hg2+的废水。反应的离子方程式为 。
②化学沉淀法:用硫化钠处理含Hg(NO3)2的废水,生成HgS沉淀。已知Ksp(HgS)=1.6×10-52,当废水中c(S2-)=1×10-5 mol·L-1时,c(Hg2+)= 。
专题八 电解质溶液中的综合应用
7. (2013·启东高三期中改编)右图表示的是25℃时,难溶氢氧化物在不同pH下的溶解度(S/mol·L-1,假定该浓度为饱和溶液中阳离子的浓度)。
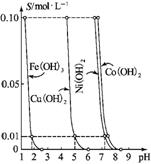
难溶金属氢氧化物的S pH图
pH图
(1) pH=3时溶液中铜元素的主要存在形式是 。
(2) 若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH (填字母)。
A. <1 B. 4左右 C. >6
(3) 在Ni(NO3)2溶液中含有少量的Co2+杂质, (填“能”或“不能”)通过调节溶液pH的方法来除去,理由是 。
(4) 25 ℃下,Ksp[Cu(OH)2 ]= 。
(5) 要使Cu(OH)2沉淀溶解,除了加酸之外,还可以加入氨水生成[Cu(NH3)4]2+,写出反应的离子方程式: 。
(6) 已知一些难溶物的溶度积常数如下表:
|
物质 |
FeS |
MnS |
CuS |
PbS |
HgS |
ZnS |
|
Ksp |
6.3×10-18 |
2.5×10-13 |
1.3×10-35 |
3.4×10-28 |
6.4×10-33 |
1.6×10-24 |
为除去工业废水中含有的Cu2+、Pb2+、Hg2+杂质,最适宜向此工业废水中加入过量的 (填字母)。
A. NaOH B. FeS C. Na2S
6. (2013·江苏高考预测题改编)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:
CaA(s) Ca2+(aq)+A2-(aq) ΔH>0
Ca2+(aq)+A2-(aq) ΔH>0
(1) 温度升高时,Ksp (填“增大”、“减小”或“不变”,下同)。
(2) 滴加少量浓盐酸,c(Ca2+) 。
(3) 若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体,写出该过程中反应的离子方程式: 。
5. (2013·山东泰安改编)污水处理分析时,常用双硫腙(H2Dz,二元弱酸)把金属离子络合成电中性的物质,再用CCl4萃取络合物,从而把金属离子从水溶液中完全分离出来。如用双硫腙(H2Dz)CCl4分离污水中的Cu2+时,先发生络合反应:Cu2++2H2Dz Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
右图是用双硫腙(H2Dz)CCl4络合萃取某些金属离子的酸度曲线。它反映了萃取某些金属离子时适宜的pH范围。E%表示某种金属离子以络合物形式被萃取分离的百分率。
某工业废水中含有Hg2+、Bi3+、Zn2+,用双硫腙(H2Dz)CCl4络合萃取法处理废水。
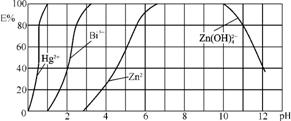
(1) 欲完全将废水中的Hg2+分离出来,须控制溶液pH= 。
(2) 当调节pH=2时,铋(Bi)的存在形式有 ,其物质的量之比为 。
(3) 萃取到CCl4中的Zn(HDz)2分液后,加入足量的NaOH溶液,充分振荡后,锌又转到水溶液中。写出反应的离子方程式: 。
4. (2013·淮阴中学学情调查)已知常温下Ksp[Fe(OH)3]=1.25×10-36,则Fe(NO3)3溶液中加入KOH溶液到pH= 时Fe3+才能完全沉淀(当溶液中某种离子浓度小于10-5mol·L-1时可看作完全沉淀,lg2=0.3,lg5=0.7)。常温下反应Fe3++3H2O Fe(OH)3+3H+的平衡常数K= (水解生成的Fe(OH)3为胶体,其浓度不代入计算式,写出计算结果)。
Fe(OH)3+3H+的平衡常数K= (水解生成的Fe(OH)3为胶体,其浓度不代入计算式,写出计算结果)。
3. (2013·连云港摸底)一种治理含Cr2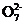 酸性工业废水的方法是向废水中加入适量的食盐,用铁作电极进行电解,Cr2
酸性工业废水的方法是向废水中加入适量的食盐,用铁作电极进行电解,Cr2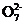 被还原为Cr3+,然后生成Cr(OH)3沉淀除去,以达到排放标准。
被还原为Cr3+,然后生成Cr(OH)3沉淀除去,以达到排放标准。
已知电解后溶液中c(Fe3+)为4.0×10-13mol·L-1,则溶液中c(Cr3+)浓度为 。
(已知:Ksp[Fe(OH)3]=4.0×10-38;Ksp[Cr(OH)3]=6.0×10-31)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com