
10. (2012·南方凤凰台信息题)常温下,有下列四种溶液:
|
① |
② |
③ |
④ |
|
0.1mol·L-1 NaOH溶液 |
pH=11 NaOH溶液 |
0.1mol·L-1 CH3COOH 溶液 |
pH=3 CH3COOH溶液 |
下列说法正确的是( )
A.由水电离出的c(H+):①>③
B. ③稀释到原来的100倍后,pH与④相同
C. ①和③混合,若溶液pH=7,则可能有:V(NaOH)>V(CH3COOH)
D. ②和④混合,若溶液显酸性,则可能有:c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
9. (2013·镇江一模)25℃时,2a mol·L-1氢氟酸水溶液中,用NaOH溶液调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系如下图所示。下列说法正确的是( )
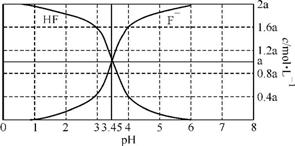
A. 当pH=3时,溶液中:c(F-)<c(Na+)
B. 当c(F-)>c(HF)时,溶液一定呈碱性
C. 当pH=3.45时,所加NaOH溶液恰好与HF完全反应
D. 当pH=4时,溶液中:c(HF)+c(Na+)+c(H+)-c(OH-)=2a mol·L-1
8. (2013·南京考前复习资料)下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
A. 0.1 mol·L-1NaHCO3溶液:
c(OH-)+2c(C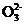 )=c(H+)+c(H2CO3)
)=c(H+)+c(H2CO3)
B. 常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7:c(Na+)>c(Cl-)=c(CH3COOH)>c(H+)=c(OH-)
C. 向0.2 mol·L-1NH4Cl溶液中加入等体积0.1 mol·L-1 NaOH溶液,得到pH>7溶液:c(Cl-)>c(N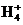 )>c(Na+)>c(NH3·H2O)>c(OH-)
)>c(Na+)>c(NH3·H2O)>c(OH-)
D. 常温下,pH=4的0.1 mol·L-1NaHA溶液:c(Na+)>c(HA-)>c(H+)>c(H2A)>c(A2-)
7. (2013·苏州调研)下列有关溶液中微粒浓度关系的叙述正确的是( )
A. 向0.1 mol·L-1NH4Cl溶液中通入一定量氨气:c(Cl-)>c(N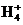 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B. 溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(HC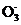 )+c(H2CO3)+c(C
)+c(H2CO3)+c(C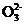 )
)
C. 向CH3COONa溶液中滴加稀盐酸至中性,所得溶液中:c(Cl-)>c(Na+)>c(CH3COOH)
D. 等物质的量浓度的CH3COOH溶液和CH3COONa溶液等体积混合,所得溶液中:
c(CH3COOH)+2c(OH-)=2c(H+)+c(CH3COO-)
6. 常温下,用0.1000mol·L-1NaOH溶液分别滴定20.00mL0.1000mol·L-1盐酸和20.00mL0.1000 mol·L-1醋酸,得到两条滴定曲线,如下图所示。
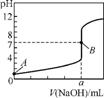
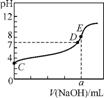
图1 图2
若以HA表示酸,下列说法正确的是( )
A. 滴定盐酸的曲线是图2
B. 达到B、D状态时,两溶液中离子浓度的关系均为 c(Na+)=c(A-)
C. 达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)
D. 当0mL<V(NaOH)<20.00mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A-)>c(Na+)>c(H+)>c(OH-)
5. (2013·泰州期末)某碱性溶液中只含有Na+、CH3COO-、H+、OH- 4种离子。下列叙述正确的是( )
A. 该溶液可能由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
B. 该溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
C. 该溶液中离子浓度一定为c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D. 加入一定量冰醋酸,c(CH3COO-)可能大于、等于或小于c(Na+)
4. (2013·扬泰南连淮三模)25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如下图所示。下列有关溶液中离子浓度关系叙述正确的是( )
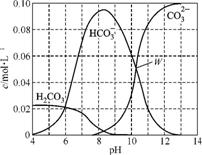
A. W点所示的溶液中:c(Na+)+c(H+)=2c(C )+c(OH-)+c(Cl-)
)+c(OH-)+c(Cl-)
B. pH=4的溶液中:c(H2CO3)+c(HC )+c(C
)+c(C )<0.1
mol·L-1
)<0.1
mol·L-1
C. pH=8的溶液中:c(H+)+c(H2CO3)+c(HC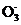 )=c(OH-)+c(Cl-)
)=c(OH-)+c(Cl-)
D. pH=11的溶液中:c(Na+)>c(Cl-)>c(C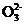 )>c(HC
)>c(HC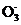 )>c(H2CO3)
)>c(H2CO3)
3. (2013·上海高考)部分弱酸的电离平衡常数如下表:
|
弱 酸 |
HCOOH |
HCN |
H2CO3 |
|
电离平衡常数(25℃) |
Ka=1.77×10-4 |
Ka=4.9×10-10 |
Ka1=4.3×10-7 Ka2=5.6×10-11 |
下列选项错误的是( )
A. 2CN-+H2O+CO2 2HCN+C
2HCN+C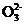
B. 2HCOOH+C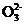
 2HCOO-+H2O+CO2↑
2HCOO-+H2O+CO2↑
C. 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D. 等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者
2. (2013·扬中中学最后一卷)常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒的物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。根据下图判断,下列说法正确的是 ( )
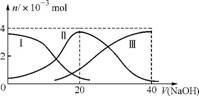
A. 当V(NaOH)=20 mL时,溶液中离子浓度大小关系:
c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
B. 等体积、等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水的大
C. NaHA溶液中:c(OH-)+c(A2-)=c(H+)+c(H2A)
D. 向Na2A溶液加入水的过程中,pH可能增大也可能减小
1. (2013·无锡期末)室温时,向20mL 0.1mol·L-1醋酸中不断滴入0.1mol·L-1 NaOH溶液,溶液的pH变化曲线如下图所示。在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是( )
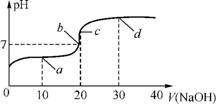
A. a点时:c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B. b点时:c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
C. c点时:c(H+)=c(CH3COOH)+c(OH-)
D. d点时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com