
12. (2013·启东高三期中改编)在容积固定的容器中发生反应:CO(g)+2H2(g) CH3OH(g) ΔH<0,各物质的浓度如下表:
CH3OH(g) ΔH<0,各物质的浓度如下表:
|
t/min |
c(CO)/mol·L-1 |
c(H2)/mol·L-1 |
c(CH3OH)/mol·L-1 |
|
0 |
0.8 |
1.6 |
0 |
|
2 |
0.6 |
x |
0.2 |
|
4 |
0.3 |
0.6 |
0.5 |
|
6 |
0.3 |
0.6 |
0.5 |
下列说法不正确的是( )
A. 24min内用氢气表示的速率为0.3 mol·L-1·min-1
B. 达平衡时,CO的转化率为62.5%
C. 反应在第2min时改变了条件,可能是加入了催化剂
D. 反应在第2min时改变了条件,可能是增加了H2的浓度
11. (2013·大纲版理综)反应X(g)+Y(g) 2Z(g) ΔH<0达到平衡时,下列说法正确的是
( )
2Z(g) ΔH<0达到平衡时,下列说法正确的是
( )
A. 减小容器体积,平衡向右移动
B. 加入催化剂,Z的产率增大
C. 增大c(X),X的转化率增大
D. 降低温度,Y的转化率增大
10. (2013·四川理综)在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g) 2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下表:
|
t/min |
2 |
4 |
7 |
9 |
|
n(Y)/mol |
0.12 |
0.11 |
0.10 |
0.10 |
下列说法正确的是( )
A.反应前2min的平均速率v(Z)=2.0×10-3mol·L-1·min-1
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
9. (2013·重庆理综)将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
|
压强/MPa 体积分数/% 温度/℃ |
1.0 |
2.0 |
3.0 |
|
810 |
54.0 |
a |
b |
|
915 |
c |
75.0 |
d |
|
1000 |
e |
f |
83.0 |
①b<f ②915℃、2.0MPa时E的转化率为60% ③该反应的ΔS>0 ④K(1000℃)>K(810℃)
上述①④中正确的有( )
A. 4个 B. 3个 C. 2个 D. 1个
8. (2013·上海高考)某恒温密闭容器中,可逆反应A(s) B+C(g) ΔH=+Q达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。下列分析正确的是( )
B+C(g) ΔH=+Q达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。下列分析正确的是( )
A. 产物B的状态只能为固态或液态
B. 平衡时,单位时间内n(A)消耗∶n(C)消耗=1∶1
C. 保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动
D. 若开始时向容器中加入1molB和1molC,达到平衡时放出热量为Q
7. (2013·山东理综)CO(g)+H2O(g) H2(g)+CO2(g) ΔH<0,在其他条件不变的情况下,下列叙述正确的是( )
H2(g)+CO2(g) ΔH<0,在其他条件不变的情况下,下列叙述正确的是( )
A. 加入催化剂,改变了反应的途径,反应的ΔH也随之改变
B. 改变压强,平衡不发生移动,反应放出的热量不变
C. 升高温度,反应速率加快,反应放出的热量不变
D. 若在原电池中进行,反应放出的热量不变
6. (2013·安徽理综)一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g) MgO(s)+CO2(g)+SO2(g) ΔH>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
MgO(s)+CO2(g)+SO2(g) ΔH>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
|
选项 |
x |
y |
|
A |
温度 |
容器内混合气体的密度 |
|
B |
CO的物质的量 |
CO2与CO的物质的量之比 |
|
C |
SO2的浓度 |
平衡常数K |
|
D |
MgSO4的质量(忽略体积) |
CO的转化率 |
5. 相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生如下反应:
CO(g)+H2O(g) CO2(g)+H2(g)
ΔH=-41 kJ·mol-1
CO2(g)+H2(g)
ΔH=-41 kJ·mol-1
相关数据如下:
|
容器 编号 |
起始时各物质物质的量/mol |
达平衡过程中 体系能量的变化 |
|||
|
CO |
H2O |
CO2 |
H2 |
||
|
① |
1 |
4 |
0 |
0 |
放出热量:32.8 kJ |
|
② |
0 |
0 |
1 |
4 |
热量变化:Q |
下列说法不正确的是( )
A. 容器①中反应达平衡时,CO的转化率为80%
B. 容器①中CO的转化率等于容器②中CO2的转化率
C. 平衡时,两容器中CO2的浓度相等
D. 容器①中CO反应速率等于H2O的反应速率
4. (2013·北京房山二模改编)在一容积为2L的恒容密闭容器中加入0.2 mol CO和0.4 mol H2,发生反应:CO(g)+2H2(g) CH3OH(g),
实验测得300℃和500℃下,甲醇的物质的量随时间的变化如下表所示。下列说法正确的是( )
CH3OH(g),
实验测得300℃和500℃下,甲醇的物质的量随时间的变化如下表所示。下列说法正确的是( )
|
时间/min 甲醇物质的量 温度 |
10 |
20 |
30 |
40 |
50 |
60 |
|
300℃ |
0.080 |
0.120 |
0.150 |
0.168 |
0.180 |
0.180 |
|
500℃ |
0.120 |
0.150 |
0.156 |
0.160 |
0.160 |
0.160 |
A. 该反应的焓变ΔH>0,升高温度,K增大
B. 300℃时,020 min H2的平均反应速率v(H2)=0.003 mol·L-1·min-1
C. 采取加压、增大H2浓度、加入催化剂的措施都能提高CO的转化率
D. 500℃时,向该容器中初始加入0.1molCO和0.3molH2,依据现有数据可计算出反应达平衡后甲醇的浓度
3. 已知,某温度下在2L密闭容器中加入一定量A,发生以下化学反应:
2A(g) B(g)+C(g) ΔH=-48.25
kJ·mol-1
B(g)+C(g) ΔH=-48.25
kJ·mol-1
反应过程中时间t与A、B浓度有下图所示关系,若测得第15min时c(B)=1.6 mol·L-1, 则下列结论正确的是( )
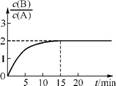
A. 该温度下此反应平衡常数为3.2
B. A的初始物质的量为4mol
C. 反应达到平衡的过程中,放出的热量是154.4kJ
D. 若使反应最终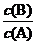 =3,只能降低反应温度
=3,只能降低反应温度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com