
5. C
4. C
3. C
2. C
1. C
12. (2012·湛江期末改编)碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知:①2CH4(g)+3O2(g) 2CO(g)+4H2O(l) ΔH1=-1
214 kJ·mol-1
2CO(g)+4H2O(l) ΔH1=-1
214 kJ·mol-1
②2CO(g)+O2(g) 2CO2(g) ΔH2=-566
kJ·mol-1
2CO2(g) ΔH2=-566
kJ·mol-1
则表示甲烷燃烧热的热化学方程式为 。
(2)①将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其负极的电极反应式为 。
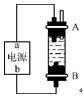
②某同学利用甲烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如右图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 (填字母)。
A. 电源中的a一定为正极,b一定为负极 B. 可以用NaCl溶液作为电解液
C. A、B两端都必须用铁作电极 D.
阴极发生的反应是2H++2e- H2↑
H2↑
(3)某学生想用该燃料电池和右图所示装置来电解饱和食盐水。
①写出反应的离子方程式: 。
②将湿润的淀粉 KI试纸放在该装置附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化。若反应的Cl2和I2的物质的量之比为5∶1,且生成两种酸,则该反应的化学方程式为
。
KI试纸放在该装置附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化。若反应的Cl2和I2的物质的量之比为5∶1,且生成两种酸,则该反应的化学方程式为
。
专题七 反应热 电化学
11. (2012·潮州二模改编)(1)一种新型燃料电池,一极通入空气,另一极通入甲烷;电解质是掺杂氧化钇(Y2O3) 的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。在熔融电解质中,O2-向 (填“正”或“负”)极移 动。电池正极的电极反应式为 ,负极的电极反应式为 。
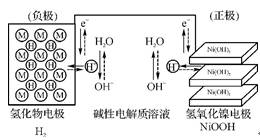
(2)“天宫一号”飞行器在太空工作期间必须有源源不断的电源供应。其供电原理是:白天太阳能帆板发电,将一部分电量直接供给“天宫一号”,另一部分电量储存在镍氢电池里,供黑夜时使用。右图为镍氢电池构造示意图(氢化物电极为储氢金属,可看作H2直接参加反应)。下列说法中正确的是 (填字母)。
A. 充电时阴极区电解质溶液的pH升高
B. 在使用过程中此电池要不断补充水
C. 放电时NiOOH在电极上发生氧化反应
D. 充电时阳极反应式为Ni(OH)2+OH--e- NiOOH+H2O
NiOOH+H2O
10.
(2012·肇庆一模改编)(1)以H2为燃料可制作氢氧燃料电池。已知:2H2(g)+
O2(g) 2H2O(l) ΔH=-572
kJ·mol-1,某氢氧燃料电池释放228.8
kJ 电能时,生成1
mol液态水。该电池的能量转化率为 。
2H2O(l) ΔH=-572
kJ·mol-1,某氢氧燃料电池释放228.8
kJ 电能时,生成1
mol液态水。该电池的能量转化率为 。
(2)科研人员新近开发出一种由甲醇和氧气以强碱作电解质溶液的新型手机电池,可使手机连续使用一个月才充一次电,该电池负极的电极反应式为 。
(3)废渣中的铁在潮湿的空气中发生吸氧腐蚀,其正极的电极反应式为 。
(4)甲醇应用于精细化工、塑料等领域,是基础的有机化工原料和优质燃料。工业上利用H2、CO和CO2等气体体系在催化剂条件下合成甲醇。
主要反应:①CO(g)+2H2(g) CH3OH(g) ΔH=-91
kJ·mol-1
CH3OH(g) ΔH=-91
kJ·mol-1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49
kJ·mol-1
CH3OH(g)+H2O(g) ΔH=-49
kJ·mol-1
副反应:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g) ΔH=-206
kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-206
kJ·mol-1
工业上可利用CH3OH(g)制备CH3OCH3(g),写出热化学方程式: 。
三、非选择题
9. (原创)请回答下列问题:
(1)现代工业将煤炭气化,既可以提高燃料的利用率、减少CO、SO2等的排放,又可以扩大水煤气的广泛用途。已知:2C(s)+O2(g) 2CO(g) ΔH1;2H2(g)+O2(g)
2CO(g) ΔH1;2H2(g)+O2(g) 2H2O(g) ΔH2。
2H2O(g) ΔH2。
则反应C(s)+H2O(g) CO(g)+H2(g) ΔH= (用含ΔH1、ΔH2的代数式表示)。
CO(g)+H2(g) ΔH= (用含ΔH1、ΔH2的代数式表示)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。如:
CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574
kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=-574
kJ·mol-1
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) ΔH2
2N2(g)+CO2(g)+2H2O(g) ΔH2
若1 mol CH4还原NO2至N2,整个过程中放出的热量为867 kJ,则ΔH2= 。
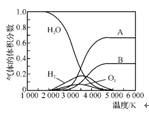
(3) H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如右图所示。图中A、B表示的物质依次是 。
8. (2012·湛江二模)下列关于各装置图的叙述中,不正确的是( )
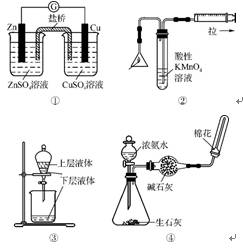
A. 装置①中,电流计的指针不偏转
B. 装置②可用于检验火柴头燃烧产生的SO2
C. 装置③能进行分液操作
D. 装置④可用于制备、干燥、收集氨气
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com