
3. C
2. A
1. B
12. 我国设计的一种风电与甲醇生产的集成系统原理如图1:
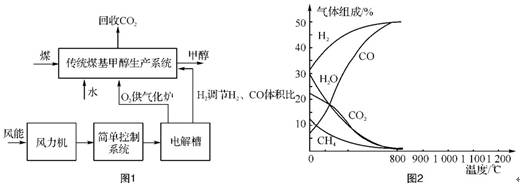
(1)该系统的主要优点是 。
(2)从气化炉中出来的气体为CH4、CO2、H2O(g)、CO及H2。今在1.01×105 Pa下,改变温度条件,各成分的体积组成关系如图2。下列有关该图像的解读中,正确的是 (填字母)。
A. 利用CH4与H2O(g)及CO2转化为合成气CO和H2理论上是可行的
B. CH4(g)+CO2(g) 2CO(g)+2H2(g)和CH4(g)+H2O(g)
2CO(g)+2H2(g)和CH4(g)+H2O(g) CO(g)+3H2(g)都是放热反应
CO(g)+3H2(g)都是放热反应

图3
C. CH4转化为合成气CO和H2的适宜条件约为900 ℃
D. 图中曲线的交点处表示反应达到平衡
(3)已知反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)。一定条件下,向体积为1
L的密闭容器中充入1 mol CO2和3 mol H2,测得3
min时v(H2)=0.5 mol·L-1·min-1,10 min时达到平衡,平衡时CO2的转化率为75%。试在图3中画出CO2和CH3OH(g)的浓度随时间的变化曲线。
CH3OH(g)+H2O(g)。一定条件下,向体积为1
L的密闭容器中充入1 mol CO2和3 mol H2,测得3
min时v(H2)=0.5 mol·L-1·min-1,10 min时达到平衡,平衡时CO2的转化率为75%。试在图3中画出CO2和CH3OH(g)的浓度随时间的变化曲线。
第七篇 考前回归
专题十六 图像图表题解题技巧
11. 氯酸钾是无机盐工业的重要产品之一,可通过下列反应制取:
NaClO3+KCl KClO3↓+NaCl
KClO3↓+NaCl
(1)实验室制取氯酸钠可通过反应3Cl2+6NaOH 5NaCl+NaClO3+H2O。今在-5 ℃的NaOH溶液中通入适量Cl2(平衡常数K=1.09×1029),此时Cl2的氧化产物主要是 ;将溶液加热,溶液中主要离子浓度随温度的变化如右图所示,图中A、B、C依次表示的离子是 。
5NaCl+NaClO3+H2O。今在-5 ℃的NaOH溶液中通入适量Cl2(平衡常数K=1.09×1029),此时Cl2的氧化产物主要是 ;将溶液加热,溶液中主要离子浓度随温度的变化如右图所示,图中A、B、C依次表示的离子是 。
(2)工业上制取氯酸钠采用在热的石灰乳中通入氯气,然后结晶除去氯化钙后,再加入一种钠盐,合适的钠盐是 。
(3)北美、欧洲国家生产氯酸钠用二级精制盐水,采用无隔膜电解法获得。生产过程中主要的化学反应如下:
总反应式:NaCl+3H2O NaClO3+3H2↑
NaClO3+3H2↑
阳极:2Cl--2e- Cl2↑
Cl2↑
阴极:2H2O+2e- H2↑+2OH-
H2↑+2OH-

液相反应:Cl2+H2O HClO+H++Cl- HClO
HClO+H++Cl- HClO H++ClO-
H++ClO-
2HClO+ClO- Cl
Cl +2Cl-+2H+
+2Cl-+2H+
①精制食盐水时,要除去其中的Ca2+、Mg2+及S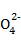 并得到中性溶液,依次加入的化学试剂是 、 、 、过滤,滤液中再加入适量的稀盐酸得一级精制盐水,再经离子交换处理或膜处理得到二级精制盐水。
并得到中性溶液,依次加入的化学试剂是 、 、 、过滤,滤液中再加入适量的稀盐酸得一级精制盐水,再经离子交换处理或膜处理得到二级精制盐水。
②电解时,必须在食盐水中加入Na2Cr2O7,其目的是防止 (写离子符号)电解过程中在阴极上放电。
(4)若NaClO3与KCl的混合溶液中NaClO3与KCl的质量分数分别为0.290和0.203(相关物质的溶解度曲线见右图)。从混合溶液中获得较多KClO3晶体的实验操作依次为 (填操作名称)、干燥。
10. (原创)冶金工业生产的铜镉渣、锌渣中铅含量较高,此外还含有铜、银、镉、铁等单质及其氧化物,某工厂拟用以下流程制备粗铅:
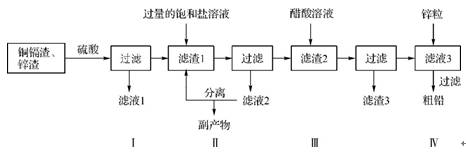
已知:镉的活泼性介于锌与铅之间,在铜镉渣中存在的形式为Cd及CdO。Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14。
(1)请写出镉及其氧化物参加反应的离子方程式: 、 。
(2)滤渣1的成分是 (写化学式)。产生滤渣2的离子方程式为 。
(3)步骤Ⅱ中选择饱和的盐溶液时,有以下三种物质供参考,相关实验数据如下:
|
饱和盐溶液成分 |
时间/min |
温度/℃ |
搅拌速度/r·min-1 |
PbSO4的转化率/% |
|
Na2CO3 |
60 |
25 |
200 |
99.70 |
|
NH4HCO3 |
60 |
25 |
200 |
75.62 |
|
(NH4)2CO3 |
60 |
25 |
200 |
99.43 |
从物质回收利用的角度,从上表可知,选择 比较合适,原因是 。
若滤液2中c(C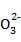 )=2.0×10-2
mol·L-1,则滤液2中c(Pb2+)= 。
)=2.0×10-2
mol·L-1,则滤液2中c(Pb2+)= 。
(4)步骤Ⅳ中加入锌粒置换铅时,因生成的铅呈海绵状附在锌粒表面,影响锌粒继续反应,应采取的简单措施为 。

三、非选择题
9. (2011·重庆高考改编)臭氧是一种强氧化剂,常用于消毒、灭菌等。O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。已知O3的起始浓度为0.021 6 mol·L-1。
|
pH t/min T/℃ |
3.0 |
4.0 |
5.0 |
6.0 |
|
20 |
301 |
231 |
169 |
58 |
|
30 |
158 |
108 |
48 |
15 |
|
50 |
31 |
26 |
15 |
7 |
(1) pH增大能加速O3分解,表明对O3分解起催化作用的是 。
(2)在30 ℃、pH=4.0的条件下,O3的分解速率为 mol·L-1·min-1。
(3)据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为 (填字母)。
A. 40 ℃、pH=3.0 B. 10 ℃、pH=4.0 C. 30 ℃、pH=7.0
8. (2012·汕头模拟)关于下列图示的说法中,正确的是( )

A. 图1所示实验可比较硫、碳、硅三种元素的非金属性强弱
B. 用图2所示实验装置排空气法收集H2
C. 用图3所示实验装置制备BaSO3沉淀
D. 图4所示装置可以用来除去SO2中的HCl
二、双项选择题
7. (原创)硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如右图所示。下列说法中正确的是( )
A. 温度一定时,Ksp(SrSO4)随c(S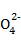 )的增大而减小
)的增大而减小
B. 三个不同温度中,T2时Ksp(SrSO4)最大
C. T2时,图中A点对应的溶液是不饱和溶液
D. T1下的SrSO4饱和溶液升温到T3后变为不饱和溶液
6. 下列图示与对应的叙述相符的是( )
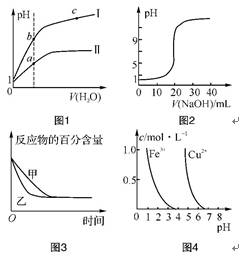
A. 图1表示同温度下,pH=1的盐酸和醋酸分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
B. 图2表示用0.100 0 mol·L-1 CH3COOH溶液滴定20.00 mL 0.100 0 mol·L-1 NaOH溶液所得的滴定曲线
C. 图3表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
D. 据图4,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在4左右
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com