
5. (2012·深圳二模)钛(Ti)具有高强度和耐酸腐蚀性,是重要的工业原料。以金红石(主要成分为TiO2,含少量Fe2O3、SiO2)为原料可制取Ti。工业流程如下:
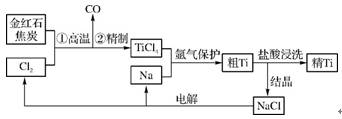
(1)粗TiCl4中含有少量FeCl3、SiCl4等,它们的部分性质如下:
|
物 质 |
沸点/℃ |
在水中 |
在乙醚中 |
|
TiCl4 |
136 |
强烈水解 |
易溶 |
|
SiCl4 |
58 |
强烈水解 |
易溶 |
|
FeCl3 |
303(升华) |
水解 |
易溶 |
从粗TiCl4中精制TiCl4的方法是 (填字母)。
A. 用水溶解后,重结晶 B. 蒸馏 C. 用乙醚萃取后,分液
(2)写出金红石高温反应制取TiCl4的化学方程式: 。
(3)写出电解熔融NaCl的化学方程式: ;阴极产物是 。
(4)粗钛产品粉碎后要用盐酸浸洗,其主要目的是 。
(5) Ti可溶解于浓HF溶液中,请完成下列离子方程式:
Ti
+ HF
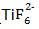 + ( )+ H2↑
+ ( )+ H2↑
4. (2012·广东六校联考)已知硫酸亚铁铵晶体为浅绿色,易溶于水、不溶于乙醇,在水中的溶解度比FeSO4和(NH4)2SO4都要小;能水解;具有还原性,但比硫酸亚铁稳定。以下是将绿矾(FeSO4·7H2O)、硫酸铵以等物质的量混合制得莫尔盐晶体的流程图:
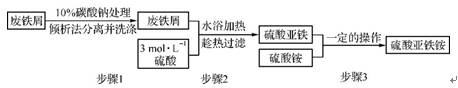
根据上图回答:
(1)为处理废铁屑表面的油污,用10% Na2CO3溶液清洗,请用离子方程式表示Na2CO3溶液呈碱性的原因: 。
(2)步骤1中采用倾析法分离出铁屑,下列适合用倾析法的有 (填字母)。
A. 沉淀的颗粒较大 B. 沉淀容易沉降 C. 沉淀呈胶状 D. 沉淀呈絮状
(3)步骤2中铁屑过量的目的是(用离子方程式表示) 。步骤2中溶液趁热过滤的原因是 。
(4)步骤3中加入(NH4)2SO4固体后,应加热至溶液表面出现晶膜时再停止加热。需经过的实验操作包括: 、 、减压过滤(或抽滤)等得到较为干燥的晶体。
(5)制得的硫酸亚铁铵中常含有杂质离子Fe3+,检验方法是 。
3. (2012·江门模拟)无水AlCl3易升华,可用作有机合成的催化剂等。工业上由铝土矿(Al2O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下:
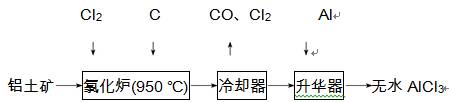
(1)氯化炉中Al2O3、Cl2和C反应的化学方程式为 。
(2)用Na2SO3溶液可除去冷却器排出尾气中的Cl2,此反应的离子方程式为 。在标准状况下,吸收112 L Cl2需要 mol Na2SO3。
(3)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,经洗涤、灼烧、冷却、称重。试写出测定无水AlCl3产品纯度的过程中有关反应的离子方程式: 、 。
(4)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3·6H2O脱去结晶水制备无水AlCl3,实现这一步的操作方法是 。
(5)工业上铝土矿经提纯后可冶炼铝,写出在950970 ℃和Na3AlF6作用下进行电解制铝反应的化学方程式: 。
2. (2012·江门一模)硫酸工业中废渣的成分为SiO2、Fe2O3、Al2O3、MgO。某探究性学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验。
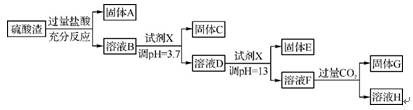
已知一水合氨电离常数Kb=1.8×10-5,其饱和溶液中c(OH-)约为1×10-3 mol·L-1。阳离子以氢氧化物形式完全沉淀时溶液的pH如下表:
|
沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
pH |
3.4 |
5.2 |
12.4 |
请回答:
(1)写出A与氢氟酸反应的化学方程式: 。
(2)上述流程中两次使用试剂X,推测试剂X是 (填字母)。
A. 水 B. 氧化铝 C. 氨水 D. 氢氧化钠
(3)由溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是 (任写两点)。
(4)写出F H+G的离子方程式: 。
H+G的离子方程式: 。
(5)证明H溶液的主要阴离子(Cl-、OH-除外)的方法是 。
1. (2012·中山一模)亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。下列是过氧化氢法生产亚氯酸钠的工艺流程图:
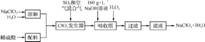
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③160 g·L-1 NaOH溶液是指160 g NaOH固体溶于水制得体积为1 L的溶液。
(1) 160 g·L-1 NaOH溶液的物质的量浓度为 mol·L-1。
若要计算该溶液的质量分数,还需要的一个条件是 (用文字说明)。
(2)发生器中鼓入空气的作用可能是 (填字母)。
A. 将SO2氧化成SO3,增强酸性 B. 稀释ClO2,防止爆炸 C. 将NaClO3还原成ClO2
(3)吸收塔内发生反应的化学方程式为 。吸收塔的温度不能超过20 ℃,其目的是 。
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是 。
(5)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是 (填字母),要得到更纯的NaClO2·3H2O晶体必须进行的操作是 (填操作名称)。
A. 蒸馏 B. 蒸发 C. 灼烧 D. 过滤 E. 冷却结晶
8.
(1)
2NaCl(熔融)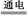 2Na+Cl2↑ (2)
Ca(ClO)2
2Na+Cl2↑ (2)
Ca(ClO)2
(3)①Ca(ClO)2 CaCO3
②
|
编 号 |
实验步骤 |
预期现象和结论 |
|
① |
加入适量1 mol·L-1盐酸溶解后,再将产生的气体导入到澄清石灰水中 |
若澄清石灰水未见浑浊,则固体中不含CaCO3;若澄清石灰水变浑浊,则固体中含有CaCO3 |
|
② |
向步骤①反应后的试管中滴入12滴品红溶液,振荡(或另外取样操作) |
若品红溶液褪色,固体中存在 Ca(ClO)2;若品红溶液不褪色,则固体中不存在Ca(ClO)2 |
。
7. (1)不正确,因为氯水中含有Cl-
(2) 2.4×10-3 mol·L-1
6.
(1)水沿导管由广口瓶进入烧瓶(或水倒吸进入烧瓶) 2OH-+CO2 C
C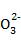 +H2O(或OH-+CO2
+H2O(或OH-+CO2 HC
HC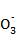 ) (2)
NaHCO3 Na2CO3和NaHCO3
) (2)
NaHCO3 Na2CO3和NaHCO3
|
实验步骤 |
预期现象和结论 |
|
步骤1:取少量白色固体于试管中,加入适量水溶解,再加入0.5 mol·L-1
BaCl2溶液至过量 |
产生白色沉淀,说明固体中含有Na2CO3 |
|
步骤2:过滤,取少量滤液(或静置,用胶头滴管取上层清液少许)于试管中,再向试管中滴加12滴酚酞试液 |
溶液变红色,说明固体中含有NaOH |
5. (1)红色粉末只含Cu2O (2)假设1和假设3
(3)
|
实验步骤 |
预期现象和结论 |
|
取少量小烧杯中的溶液于试管中,滴加12滴0.01
mol·L-1 KMnO4溶液,振荡 |
若溶液褪色,则假设3成立;若溶液不褪色,则假设1成立 |
4.
(1)
NaClO+CO2+H2O NaHCO3+HClO
NaHCO3+HClO
(2)
|
所加试剂 |
预期现象和结论 |
|
①1.0 mol·L-1 淀粉-KI溶液 ②澄清石灰水 |
③若A中溶液变蓝色,B中溶液不褪色(无变化),C中溶液不变浑浊(无变化),则消毒液未变质 ④若A中溶液不变蓝色(无变化),B中溶液不褪色(无变化),C中溶液变浑浊,则消毒液完全变质 |
(3)②酸式 ③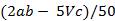
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com