
7.
(1)  SO2+NaOH
SO2+NaOH NaHSO3 (2)提高铁元素的浸出率 抑制Fe3+水解
NaHSO3 (2)提高铁元素的浸出率 抑制Fe3+水解
(3) Cl2+2Fe2+ 2Cl-+2Fe3+ Cl2、HCl
2Cl-+2Fe3+ Cl2、HCl
6.
(1)
H2SiF6+6NH4HCO3 6NH4F+H2SiO3↓+6CO2↑+3H2O 一定条件下,NaF比NaCl、NH4Cl、NH4F的溶解度小 (2)过滤 洗涤
6NH4F+H2SiO3↓+6CO2↑+3H2O 一定条件下,NaF比NaCl、NH4Cl、NH4F的溶解度小 (2)过滤 洗涤
(3)加热蒸发溶剂,析出少量晶体后冷却结晶
(4)除去晶体表面的杂质 (5)必须保证H2SiF6能完全反应,防止在进行反应②时H2SiF6与NaCl反应生成Na2SiF6沉淀,混入NaF中影响NaF纯度;同时过量的相对廉价原料NH4HCO3可以提高H2SiF6的转化率
5.
(1)
B (2)
TiO2+2C+2Cl2 TiCl4+2CO(或TiO2+2C
TiCl4+2CO(或TiO2+2C Ti+2CO↑、Ti+2Cl2
Ti+2CO↑、Ti+2Cl2 TiCl4)
TiCl4)
(3) 2NaCl (熔融) 2Na+Cl2↑ 钠(或Na)
2Na+Cl2↑ 钠(或Na)
(4)除去粗钛产品中剩余的少量钠,促进NaCl晶体析出 (5) 1 6 1 2 H+ 2
4.
(1)
C +H2O
+H2O HC
HC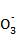 +OH- (2)
AB
+OH- (2)
AB
(3) Fe+2Fe3+ 3Fe2+ 防止溶液冷却时,硫酸亚铁因析出而损失 (4)蒸发浓缩 冷却结晶 (5)取少量制得的硫酸亚铁铵于试管中,加入适量的蒸馏水溶解,滴加12滴KSCN溶液,若溶液变血红色,则含Fe3+
3Fe2+ 防止溶液冷却时,硫酸亚铁因析出而损失 (4)蒸发浓缩 冷却结晶 (5)取少量制得的硫酸亚铁铵于试管中,加入适量的蒸馏水溶解,滴加12滴KSCN溶液,若溶液变血红色,则含Fe3+
3.
(1)
Al2O3+3Cl2+3C 2AlCl3+3CO
2AlCl3+3CO
(2) S +Cl2+H2O
+Cl2+H2O S
S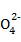 +2Cl-+2H+ 5
+2Cl-+2H+ 5
(3) Fe3++3OH- Fe(OH)3↓ Al3++4OH-
Fe(OH)3↓ Al3++4OH- Al
Al +2H2O (4)在干燥的HCl气流中加热
+2H2O (4)在干燥的HCl气流中加热
(5) 2Al2O3(熔融)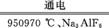 4Al+3O2↑
4Al+3O2↑
2.
(1)
SiO2+4HF SiF4↑+2H2O (2) D
SiF4↑+2H2O (2) D
(3)镁离子沉淀不完全;氢氧化铝沉淀溶解不完全
(4) Al +CO2+2H2O
+CO2+2H2O Al(OH)3↓+HC
Al(OH)3↓+HC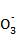
(5)取12 mL H溶液,加入过量BaCl2(CaCl2)溶液,没有沉淀产生;再滴加NaOH溶液,有白色沉淀产生(或再滴加盐酸,有无色无味气体产生),证明含有HC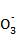 (或其他合理答案)
(或其他合理答案)
1.
(1)
4 溶液的密度 (2) B (3) 2ClO2+2NaOH+H2O2 2NaClO2+O2+2H2O 防止H2O2受热分解 (4)连续测定溶液的pH (5)
BED 重结晶
2NaClO2+O2+2H2O 防止H2O2受热分解 (4)连续测定溶液的pH (5)
BED 重结晶
8. 以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸铵和氧化铁红颜料,原料的综合利用率较高。其主要流程如下:
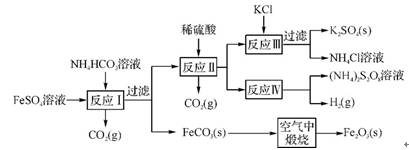
(1)反应Ⅰ前需在FeSO4溶液中加入 (填字母),以除去溶液中的Fe3+。
A. 锌粉 B. 铁屑 C. KI溶液 D. H2
(2)反应Ⅰ需控制反应温度低于35 ℃,其目的是 。
(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是 。
(4)反应Ⅳ常被用于电解生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为 。
专题十一 化学工艺流程的题型研究
7. (2011·江苏高考)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:

回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g) 2SO3(g),该反应的平衡常数表达式K= ;过量的SO2与NaOH溶液反应的化学方程式为 。
2SO3(g),该反应的平衡常数表达式K= ;过量的SO2与NaOH溶液反应的化学方程式为 。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是 、 。
(3)通氯气氧化时,发生的主要反应的离子方程式为 ;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为 (写化学式)。
6. 氟化钠是一种重要的氟盐,主要用作农业杀菌剂、杀虫剂、木材防腐剂。实验室可通过下图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵:

有关物质在水中的溶解度见下表:
|
温 度 |
NH4Cl |
NaCl |
NaF |
Na2SiF6 |
|
10 ℃ |
33.3 |
35.0 |
- |
- |
|
20 ℃ |
37.2 |
35.5 |
4.0 g |
微溶于水 |
|
30 ℃ |
41.4 |
35.8 |
- |
- |
请回答下列问题:
(1)上述流程中发生两步化学反应,反应①的化学方程式为 ;
反应②能进行是因为 。
(2)操作Ⅰ的名称是 ,操作Ⅲ的名称是 。
(3)操作Ⅱ的具体过程是 。
(4)操作Ⅲ的作用是 。
(5)流程中NH4HCO3必须过量,其原因是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com